机器人辅助微创食管切除术
背景
食管切除术是晚期难治性良性食管疾病和局部晚期食管恶性肿瘤综合治疗的核心组成部分 [1,2]。考虑到该手术的围手术期并发症的发生率和术中的复杂性,外科医生不断改进手术方法,以提高患者安全性,同时保证最佳的预后。尽管最佳手术切除方式仍存在广泛的争论,但随着外科技术的接受度不断提高,手术方式也在不断改进和优化。
经胸开放食管切除术(OE)、腔镜微创食管切除术(MIE)和机器人辅助微创食管切除术(RAMIE)是治疗进展期良性和恶性食管疾病的常用方法[3-5]。
与MIE和RAMIE相比,OE围手术期并发症发生率更高[6]。与OE相比,MIE的优势在于手术创伤小(失血、手术局部损伤和肺部感染)、住院时间短和并发症少[7,8],但清晰度有限的二维图像、欠佳的光学稳定性和有限的自由度是MIE内在局限性 [9]。
早期的研究证实了RAMIE的可行性,且优于MIE[9-14]。RAMIE通过灵活转换实现精确切除,并通过提供自我辅助功能等技术上的发展,克服了传统 MIE 固有的技术局限 [8,9]。除了技术上的优势,RAMIE还保证了安全性,提供了相同的肿瘤学结果,并在一定程度上改善了围手术期结果[9-15],这使得RAMIE越来越受欢迎。
最初的机器人辅助食管切除术始于本世纪初。2003年,Horgan等报道了最早的机器人辅助经裂孔食管切除术 [16]。不久,Kernstine 等首次报道McKeown 三切口机器人辅助食管切除术的病例研究。该研究包括 14例患者,2例癌前病变和12例食管癌。3例患者胸部行机器人手术,腹部行开腹手术;另一亚组(n=3)接受了类似的方法,但术中行胸导管结扎,且腹部使用腹腔镜;最后一个亚组 (n=8) 进行了完全RAMIE。中位手术时间为11.2小时,机器人操作时间为4.9小时(经裂孔入路为4.2小时),该研究凸显了提高术中效率的必要性 [17]。Vander Sluis等报道了一项108 例机器人辅助手术的前瞻性研究,其中位手术时间为 381 分钟。肺部并发症 (37%)是较常见的术后并发症,术中出血量中位数为340 mL。吻合口瘘和乳糜胸的发生率分别为19%和18%。这一结果与当时RAMIE的结果一致[11]。
Sarkaria等的一项前瞻性临床试验,对比了RAMIE (n=64)与开放经胸手术(n=164)的临床结果。多数患者接受了Ivor-Lewis术(RAMIE,n=62;OE,n=103),并接受了诱导放化疗(80.2%和73.4%)。两组之间的R0切除率相当(97.2% vs. 96.9%),但RAMIE组的ICU入住率较低(P = 0.03),肺部并发症(14%vs34%,P = 0.014)和感染并发症(17.2% vs. 38%, P=0.029)的发生率更低。两组之间的主要并发症、30天或90天死亡率无显著差异,但RAMIE组失血量较少(250 vs350 mL,P<0.001)、疼痛较轻(P<0.05)[18]。
ROBOT试验是第一项将RAMIE (n=56) 与OE (n=56)进行比较的随机对照研究,以评估术后并发症和生活质量的差异 [19]。与OE相比,RAMIE 可降低术后并发症、减少失血量(400 mL与569 mL,P< 0.001),并缩短术后疼痛持续时间。另一项正在进行的多中心前瞻性试验,比较了RAMIE 与 MIE治疗可切除食管鳞癌的临床结果[20]。此研究将比较 RAMIE(n=180)和 MIE(n=180)在可切除食管鳞癌患者中的安全性和有效性。主要研究终点包括5年总生存率、3年总生存率、5年无病生存率、生活质量和短期疗效[20]。
此外,与MIE方法相比,改进的淋巴结清扫是RAMIE的一个优势[21-23]。Deng等基于RAMIE 与 MIE 结果进行倾向评分匹配分析,结果显示前者清扫喉返神经旁淋巴结数(平均:1.0±1.8 vs 0.4±0.8;P=0.033)和淋巴结清扫总数更多(20.6 vs 17.9;P=0.048),且不会增加喉返神经麻痹的风险 [21]。
基于现有的回顾性研究和 RAMIE 试验,越来越多的数据表明 RAMIE 与OE和MIE方法相比可提供更好的术后结果和有利的技术优势 [11,17,19]。
接下来以行RAMIE的食管癌患者为例探讨我们的技术方法和围术期治疗。
术前评估
RAMIE的术前评估与接受MIE或OE的患者没有区别。患者接受完整的术前检查,包括体格检查、实验室检验、影像学诊断和分期。患者的营养状况评估很有必要,尤其是在经历了诱导化放疗或经口进食困难的患者。肺功能测试和选择性的心脏负荷测试进一步评估了患者的心肺储备。此外,外科医生应优化患者术前体能,让患者参与康复训练,以改善患者生理储备,并促进术后恢复。
PET-CT和胸、腹、盆腔CT用于检测患者是否存在远处转移,以及评估对诱导治疗的反应。食管胃十二指肠镜检查(EGD)和超声内镜分期(EUS)通过评估肿瘤浸润深度和区域淋巴结受累,对局部进展期恶性肿瘤进行分期。对于上胸段至中段食管病变,使用支气管镜评估气管、支气管受累情况。
手术操作
腹部部分
围手术期注意事项和患者体位
所有患者在麻醉诱导前接受预防剂量的依诺肝素或肝素皮下注射。患者在全身麻醉诱导及经口气管插管后,取仰卧位。在我们医院,我们通常使用动脉导管和大口径外周静脉导管进行血流动力学监测和复苏。
EGD 通常由手术外科医生操作,主要用于评估肿瘤的近端和远端的范围,评估胃的受累、贲门受侵情况,这可能会影响远端切缘,从而应避免应用胃作为替代器官。在内镜检查期间至关重要的是尽量减少充气以防止腹腔镜操作时肠道过度扩张。患者位于床的右侧,以便于使用肝脏牵开器(DiamondFlex,Snowden Pencer,USA)和稳定系统(MediFlex,USA)。在反向Trendelenburg定位过程中(头高脚低位),在患者足部放置一块踏板以支撑患者的体位。患者的左臂被卷起并固定,而右臂仍然被外展。
手术台的位置允许机器人推车设备和手臂(da Vinci Xi Surgical Robot,Intuitive Surgical Inc.,Sunnyvale,CA,USA)安全进入患者的中线。
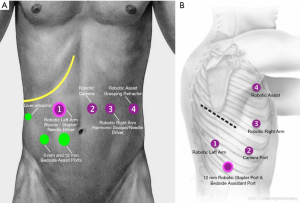
穿刺器的放置
腹部端口需根据外科医生的判断进行安置。一般来说,无论是在中线镜头位置,还是“右手”(左侧中上腹部)操作位置,我们均使用标准的5 mm光学分离器在直视下进入腹部。该穿刺器后来被替换为机器人8 mm穿刺器,同时5 mm光学分离器被保留并在右侧肋下部位用于引入肝脏牵开器。或者,可以直接使用Hassan技术将机器人8 mm穿刺器通过直接开放切口插入。CO2气腹保持15 mmHg压力下,并利用30°机器人摄像头在可视下安全放置后续穿刺器。
尽管较新的机器人平台(da Vinci Xi, Intuitive Surgical, USA)允许更近的距离,我们仍建议机器人穿刺器之间的距离约为9 cm,以尽量减少碰撞并优化床边辅助。在左肋下缘和左锁骨中线与中腹交点插入8 mm穿刺器,并在右锁骨中线与中腹交点插入12 mm机器人穿刺器,以便之后置入机器人吻合器。在该部位使用了一个8 mm的异径管,用以在大部分解剖过程中容纳“左手”器械。一个5 mm的穿刺器也被安装在右肋下缘,应注意避免损伤升结肠。肝脏牵开器放置在5 mm穿刺孔处,机器人无创抓钳放置在8mm左肋下缘穿刺孔处(Small Grasping Retractor,Intuitive Surgical,USA),双极钳(Force Bipolar 或 Fenestrate Bipolar,Intuitive Surgical,USA)在12 mm右锁骨中线穿刺孔并使用8 mm变径管,机器人超声刀(Harmonic Scalpel;Ethicon Inc 和 Intuitive Surgical,USA)在8mm左锁骨中线穿刺孔。
12 mm标准腹腔镜穿刺器插入右脐旁水平,位于12 mm右锁骨中孔和8 mm脐部穿刺器之间。如果不使用机器人吻合,此穿刺器用于床边辅助、额外牵拉及之后的吻合。其次,该穿刺器为胃网膜动脉弓和网膜动员时的镜头使用提供了备用入口。
RAMIE腹部穿刺器的安装见图1。
胃部游离
在实现反Trendelenburg位(头高脚低位)后,我们首先暴露小网膜囊、分离小网膜。进行有限解剖以确定膈肌裂孔脚、主动脉、胰体和尾部,以及腹腔干的受累情况,从而对疾病范围和可切除性进行初步评估。
在此解剖过程中,可能会遇到变异的肝左动脉,如果在临时动脉结扎后没有发现肝左叶有血管损伤的证据,则通常会被离断。大约在5%的情况下,必须保留这一重要的变异动脉以避免严重的肝缺血。解剖胃后、肝周和脾周淋巴结,并将其分离至胃左动静脉分界线以上。这些淋巴组织将与手术标本一起被整体切除。使用机器人辅助臂自前缘牵开胃部,可实现胃左血管的最佳可视化和骨骼化,并提供最佳的腹腔干暴露。通过12 mm的“左手”穿刺器插入血管闭合器,离断胃左血管蒂。
将胃向前牵拉的同时,通过粘连松解进一步实现胃后部的动员,并使用超声刀从后入路分离胃短动脉。在分离胃网膜左血管的同时解剖胃脾血管,再次进入小网膜囊,进一步将胃游离至幽门。
近红外成像 (NIFI) 术中荧光血管造影是一种有用的辅助工具,在术中使得管胃的灌注可视化[24,25]。静脉注射10 mg ICG,并通过机器人平台光学系统(Firefly,Intuitive Surgical,Sunnyvale,CA,USA)内置的近红外荧光成像观察管胃和血管供应情况。根据我们以往的经验,在静脉输注ICG后(中位时间为37秒),在所有病例中均定位了胃网膜弓[24,26]。Ladak等肯定了术中ICG造影在显示微血管灌注和管胃部位选择中的作用,从而减少了食管切除术后的吻合口瘘的发生率[27]。初步的研究报告了NIFI的一些创新的应用,包括其在机器人辅助腹腔镜胃切除术时有利于术中淋巴结的可视化[28]。
使用左侧机器人辅助臂,将胃大弯向内和向上牵扯充分暴露胃网膜动脉弓。注意沿胃大弯完全保留胃网膜动脉弓,手术医生必须坚持“无接触”技术,以减少管胃的损伤。
幽门成形术
用左侧机器人辅助臂将胃窦侧拉向左侧,以暴露幽门。Mayo静脉可用作标识幽门成形术的位置。不可吸收的回缩缝线(2-0 Ethibond,Covidien,USA)放置在幽门的外侧。使用超声刀打开幽门,并以Heineke-Mikulicz法进行幽门成形术。使用4~6根线间断缝合横向闭合幽门。
管胃的制作
使用左肋下机器臂将胃底向左上象限移动,另一个机器臂将胃窦向下移动。移出鼻胃管后,将机器人胃肠内闭合器插入12 mm“左侧”辅助穿刺孔。应用连续的切割闭合器制作直径为3~4 cm的管状胃。在连续切割闭合过程中注意保持管胃的正确方向。将管胃固定到手术标本上,以在手术的胸腔操作部分可顺利牵拉至胸腔。
空肠造口管放置
使用标准腹腔镜方法放置F12空肠管。
胸腔部分
孔位放置
患者取左侧卧位。右臂应处于水平位置,并应用无菌单遮盖。带有光学分离器的5 mm机器人穿刺器可用于在直视下从腋后线最前穿刺器上进入胸部(Small Grasping Retractor, Intuitive Surgical, USA)。胸腔吸入CO2(8 mmHg),并放置其余穿刺器。在直视下将8 mm镜头穿刺器置入腋中线后缘第8肋间,并在第3和第5肋间放置额外的8 mm穿刺器。一个8 mm的机器人穿刺器被放置在大约第8或第9肋间,大致在裂孔上方与肩胛骨尖端对齐(Force Bipolar Grasper 或 Fenestrated Biopolar Grasper,Intuitive Surgical,美国)。一个12 mm的机器人穿刺器放置在“左手”穿刺器和镜头穿刺器之间的横隔水平。这用作辅助孔及机器人吻合孔。机器人主机在上方移动并停靠。
RAMIE机器人穿刺器胸腔部分的安置见图1。
食管游离
使用机器人抓钳向上牵拉右肺下叶,使用超声刀将下肺韧带分离至下肺静脉水平。随后,向前牵开右肺,并使用超声刀切开覆盖食道的后纵隔胸膜至奇静脉水平。淋巴结组织均与食道一起切取,应仔细解剖清扫隆突下淋巴结,以避免损伤气管支气管的膜部。钝器解剖、精确利用能量器械是防止对气道造成热损伤的关键措施。机器人双极钳可能是解剖的另一种选择。成功解剖后纵隔至奇静脉弓水平后,用血管吻合器将奇静脉切开。迷走神经也被分开以减少对喉返神经的牵拉损伤,并可保留或分离其肺支的尾部,从而降低误吸和肺部并发症的风险。
机器人可以在空间狭小的上纵隔区域进行更好的解剖,而使用胸腔镜操作可能更具挑战性。Chao等使用RAMIE的方法后发现在减少喉返神经损伤和系列并发症发生率的同时,可获得更多的左喉返神经链的淋巴结清扫数目 [29]。REVATE试验是一项正在进行的随机对照试验,前瞻性地比较RAMIE和MIE,以评估沿左侧喉返神经进行根治性淋巴结清扫的临床结果[23]。
食管游离应在奇静脉弓上方3~4 cm处终止。如有必要,可仔细分离至胸廓入口。所有胸导管分支和主食管穿支都可以用夹子予以结扎。我们在实践中没有常规进行,但其他学者建议常规行胸导管切除术。尽管尚不清楚整体切除胸导管是否会显著影响预后而不增加潜在的并发症,但根据实际情况和现有外科技术,这很容易在术中完成。一些研究表明,胸导管切除在淋巴结取样和肿瘤分期方面具有优势[30]。其它匹配研究表明,在常规切除或未切除胸导管的情况下,总体生存率或无病生存率没有差异 [31]。
食管裂孔解剖完成后,将管胃和标本拉入胸腔,同时保持适当的方向,U型钉应朝向侧面。要注意小心处理管胃,以减少对管胃和相邻胃网膜动脉弓的损伤。将固定管胃和标本的缝合线剪开,并将管胃固定在膈肌上以防止其缩回腹腔。将标本横向折叠并向上移动到胸廓入口处。
在沿着对侧胸膜、主动脉周围区域、左主支气管和心包等结构解剖、清扫淋巴结时,外科医生必须注意保护气道。
把鼻胃管向近端回退,在奇静脉上方3~4 cm处离断食道。延伸第5肋间的穿刺切口并置入切口保护器。将标本整体取出,并将边缘送病理学检查。
食管胃吻合术
食管残端由机器人辅助抓钳固定,将28 mm砧座插入末端食管开口。用一根“棒球”荷包缝合线将砧座固定,并在固定砧座后使用额外的荷包线进行加固。将管胃从膈肌上解除固定,在管胃近端切开,将加长端端吻合器(DST XL EEA Stapler,Covidien,USA)从切口置入并放入管胃近端。吻合器钉沿着管状胃的胃大弯展开,使其刚好位于血管弓起点上方。钉砧和吻合器对接,并以正确的方向对合组织,进行吻合,并将切除的胃组织、管胃多余组织、吻合器一并移除。可以用大网膜覆盖来固定吻合口(如果在腹部分离获得)。研究表明,用大网膜包裹吻合口可减少吻合口瘘和狭窄率[32-34]。在直视下重新置入鼻胃管。
术后管理
通常,患者在手术室拔管并入住重症监护室。我们建议适量补液,鼓励患者在术后第一天尽早下地活动。患者在术后第2天转入普通病房,并开始通过空肠造口管慢速管饲营养。在术后第5天,移除鼻胃管并进行钡剂食管造影以评估吻合口的愈合情况。如没有吻合口瘘,开始流质饮食,并在出院前拔掉胸管。患者出院后1~2周门诊随访,评估并移除吻合口的引流管,根据患者对固体食物的耐受情况移除空肠营养管。
讨论
尽管MIE降低了术后并发症发生率,但将RAMIE与MIE或OE进行比较的研究有限。MIE的缺点主要集中在技术限制:自由度有限、学习曲线长、二维视图,以及需要与助手进行协作 [35,36]。RAMIE的技术进步使外科医生能够克服视觉限制,同时提供纵隔淋巴结、支气管周围和食管周围平面的精确无创解剖 [9]。MIE中具有挑战性的部分(建立食管胃吻合、砧座加固,幽门成形,食道裂孔剥离)通过机器人高度可视化和器械灵活性得以轻易完成。由于机器人具有优越的光学性能和自由度,解剖的精度更高。此外,优越的三维视图、高放大倍率、灵巧性和自辅助功能是机器人辅助手术的优势特征的代表。
机器人方法的适应性允许外科医生开展多种方式的胸内吻合:机器人手工吻合、圆形吻合或线性吻合以及吻合器吻合失败的机器人手工缝合。Plat等发表了一篇综述,讨论了多种吻合技术的优点和局限性 [37]。圆形吻合被广泛采用,特别是外科医生在机器人平台的过渡期。线性吻合和手工吻合在技术上更具挑战性,但其操作不需要助手帮助[37]。目前尚无前瞻性研究比较哪种技术更好。
本机构的结果显示在食管癌患者中使用RAMIE是具有优势的。
Okusanya等描述了我们在25名患者中开展RAMIE的初步经验[14]。中位手术时间为661 min,中位失血量为250 mL。中转率为8%(n = 4),但术后30或90天内无患者死亡。该研究结果与我们之前MIE的研究(n=1 011)死亡率相当(0%vs 2.8%)。R0切除率(96% vs 98%)、淋巴结清扫数目(26 vs 19)和吻合口瘘发生率(4%vs 5%) 也具有可比性 [38]。Cerfolio等对22名接受 RAMIE的患者进行了回顾性研究,中位失血量为75 mL,中位淋巴结清扫数为17枚。没有患者接受中转开胸,但1例患者中转开腹。所有患者均实现了R0切除[13]。Weksler等证明了RAMIE (n=11)与MIE (n=26)具有相似的临床结果。两种方法的手术时间(439 vs 483 min)、失血量(20 vs26)、淋巴结清扫个数(23 vs 23)和 ICU 留置天数(8.7 vs. 10)均相当[39]。
鉴于RAMIE越来越能引起人们的兴趣且应用不断增加,外科技术培训亦在增加,学习曲线也变得越来越清晰,可以为学员和外科医生提供指导。Hernandez等认为经验丰富的食管外科医生熟练掌握RAMIE需要20例手术的学习。Zhang 等报道第26例RAMIE后,手术时间缩短 [40,41]。Sarkaria等基于100 名在纪念斯隆凯特琳癌症中心接受RAMIE且90天死亡率为1%的患者队列中进行学习曲线研究,并建议需要40~45个病例才能达到熟练掌握手术操作并最大限度地减少并发症[42]。在受监管程序下进行学习曲线评估时,24例可以熟练掌握,而未监管则需要70例[43] 。上消化道外科医生协会和大不列颠及爱尔兰腹腔镜外科医生协会认为30~50个病例的学习后可能会熟练掌握 MIE 方法[44]。其它回顾性研究认为至少需要35~40例手术积累才能熟练掌握MIE [45]。
RAMIE学习曲线短,可能归因于以前在非机器人食管切除术中和既往的手术中积累的经验。因此,RAMIE的学习曲线可以随着外科医生和学员有监管/培训计划的实施而减少。
改进RAMIE方法的手术操作和减少并发症的创新仍在进行中。迄今为止,经颈单孔机器人辅助食管切除术已经在3项临床前尸体研究中进行,2项研究使用达芬奇单孔机器人(SP),1项研究使用第4代达芬奇机器人(Xi)。在3个尸体模型中都完成了食管游离,但与Xi(隆突水平)相比,SP食管游离范围更广(到裂孔水平)。高位食管肿瘤的切除、左上喉返神经水平的淋巴结清扫得到改善,以及胸膜外手术操作使得肺并发症减少是这种方法潜在的优势 [46]。术中辅助诊断手段,包括用于术中分子成像 (IMI) 的肿瘤特异性荧光标记,类似于用于检测肺腺癌,可能在检测食管癌和术中评估肿瘤边缘等方面发挥作用 [47]。
我们详细说明了RAMIE的可行性,这与报道RAMIE具有优越的短期结果的研究一致,但仍需要额外的前瞻性研究来确定 RAMIE 和 MIE 与 OE 之间长期肿瘤学结果的差异。
Acknowledgments
Funding: This review was supported by the Department of Cardiothoracic Surgery at the University of Pittsburgh and the NCI T32CA113263-11 (Ekeke).
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Christopher R. Morse and Uma M. Sachdev) for the series “Minimally Invasive Esophagectomy” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aoe-20-34). The series “Minimally Invasive Esophagectomy” was commissioned by the editorial office without any funding or sponsorship. ISS serves as an unpaid editorial board member of Annals of Esophagus from Mar 2020 to Feb 2022. JDL reports grants from University of Texas SWMC, grants from Anpac Tech of USA, non-financial support from Covidien, other from Intuitive Surgical Inc., Proctor and Gamble, and Cigna Corp, outside the submitted work. ISS reports grants and personal fees from Intuitive Surgical, Inc., personal fees from On Target Laboratories, personal fees from Cambridge Medical Robotics, and personal fees from Auris Medical. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Omloo JM, Lagarde SM, Hulscher JB, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial. Ann Surg 2007;246:992-1000; discussion 1000-1. [Crossref] [PubMed]
- Burmeister BH, Smithers BM, Gebski V, et al. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phase III trial. Lancet Oncol 2005;6:659-68. [Crossref] [PubMed]
- Turner GG. Carcinoma of the (esophagus the question of its treatment by surgery. Lancet 1936;227:130-4. [Crossref]
- Lewis I. The surgical treatment of carcinoma of the oesophagus; with special reference to a new operation for growths of the middle third. Br J Surg 1946;34:18-31. [Crossref] [PubMed]
- Mathisen DJ, Grillo HC, Wilkins EW Jr, et al. Transthoracic esophagectomy: a safe approach to carcinoma of the esophagus. Ann Thorac Surg 1988;45:137-43. [Crossref] [PubMed]
- Hulscher JB, van Sandick JW, de Boer AG, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med 2002;347:1662-9. [Crossref] [PubMed]
- Nguyen NT, Follette DM, Wolfe BM, et al. Comparison of minimally invasive esophagectomy with transthoracic and transhiatal esophagectomy. Arch Surg 2000;135:920-5. [Crossref] [PubMed]
- Luketich JD, Alvelo-Rivera M, Buenaventura PO, et al. Minimally invasive esophagectomy: outcomes in 222 patients. Ann Surg 2003;238:486-94; discussion 494-5. [PubMed]
- van Hillegersberg R, Boone J, Draaisma WA, et al. First experience with robot-assisted thoracoscopic esophagolymphadenectomy for esophageal cancer. Surg Endosc 2006;20:1435-9. [Crossref] [PubMed]
- Okusanya OT, Hess NR, Luketich JD, et al. Technique of robotic assisted minimally invasive esophagectomy (RAMIE). J Vis Surg 2017;3:116. [Crossref] [PubMed]
- van der Sluis PC, Ruurda JP, Verhage RJ, et al. Oncologic Long-Term Results of Robot-Assisted Minimally Invasive Thoraco-Laparoscopic Esophagectomy with Two-Field Lymphadenectomy for Esophageal Cancer. Ann Surg Oncol 2015;22 Suppl 3:S1350-6. [Crossref] [PubMed]
- Sarkaria IS, Rizk NP. Robotic-assisted minimally invasive esophagectomy: the Ivor Lewis approach. Thorac Surg Clin 2014;24:211-22. vii. [Crossref] [PubMed]
- Cerfolio RJ, Bryant AS, Hawn MT. Technical aspects and early results of robotic esophagectomy with chest anastomosis. J Thorac Cardiovasc Surg 2013;145:90-6. [Crossref] [PubMed]
- Okusanya OT, Sarkaria IS, Hess NR, et al. Robotic assisted minimally invasive esophagectomy (RAMIE): the University of Pittsburgh Medical Center initial experience. Ann Cardiothorac Surg 2017;6:179-85. [Crossref] [PubMed]
- Zhang X, Su Y, Yang Y, et al. Robot assisted esophagectomy for esophageal squamous cell carcinoma. J Thorac Dis 2018;10:3767-75. [Crossref] [PubMed]
- Horgan S, Berger RA, Elli EF, et al. Robotic-assisted minimally invasive transhiatal esophagectomy. Am Surg 2003;69:624-6. [PubMed]
- Kernstine KH, DeArmond DT, Shamoun DM, et al. The first series of completely robotic esophagectomies with three-field lymphadenectomy: initial experience. Surg Endosc 2007;21:2285-92. [Crossref] [PubMed]
- Sarkaria IS, Rizk NP, Goldman DA, et al. Early Quality of Life Outcomes After Robotic-Assisted Minimally Invasive and Open Esophagectomy. Ann Thorac Surg 2019;108:920-8. [Crossref] [PubMed]
- van der Sluis PC, Ruurda JP, van der Horst S, et al. Robot-assisted minimally invasive thoraco-laparoscopic esophagectomy versus open transthoracic esophagectomy for resectable esophageal cancer, a randomized controlled trial (ROBOT trial). Trials 2012;13:230. [Crossref] [PubMed]
- Yang Y, Zhang X, Li B, et al. Robot-assisted esophagectomy (RAE) versus conventional minimally invasive esophagectomy (MIE) for resectable esophageal squamous cell carcinoma: protocol for a multicenter prospective randomized controlled trial (RAMIE trial, robot-assisted minimally invasive Esophagectomy). BMC Cancer 2019;19:608. [Crossref] [PubMed]
- Deng HY, Luo J, Li SX, et al. Does robot-assisted minimally invasive esophagectomy really have the advantage of lymphadenectomy over video-assisted minimally invasive esophagectomy in treating esophageal squamous cell carcinoma? A propensity score-matched analysis based on short-term outcomes. Dis Esophagus 2019;32:doy110. [Crossref] [PubMed]
- Park S, Hwang Y, Lee HJ, et al. Comparison of robot-assisted esophagectomy and thoracoscopic esophagectomy in esophageal squamous cell carcinoma. J Thorac Dis 2016;8:2853-61. [Crossref] [PubMed]
- Chao YK, Li ZG, Wen YW, et al. Robotic-assisted Esophagectomy vs Video-Assisted Thoracoscopic Esophagectomy (REVATE): study protocol for a randomized controlled trial. Trials 2019;20:346. [Crossref] [PubMed]
- Okusanya O, Lu M, Luketich JD, et al. Intraoperative near infrared fluorescence imaging for the assessment of the gastric conduit. J Thorac Dis 2019;11:S750-4. [Crossref] [PubMed]
- Okusanya OT, Hess NR, Luketich JD, et al. Infrared intraoperative fluorescence imaging using indocyanine green in thoracic surgery. Eur J Cardiothorac Surg 2018;53:512-8. [Crossref] [PubMed]
- Sarkaria IS, Bains MS, Finley DJ, et al. Intraoperative near-infrared fluorescence imaging as an adjunct to robotic-assisted minimally invasive esophagectomy. Innovations (Phila) 2014;9:391-3. [Crossref] [PubMed]
- Ladak F, Dang JT, Switzer N, et al. Indocyanine green for the prevention of anastomotic leaks following esophagectomy: a meta-analysis. Surg Endosc 2019;33:384-94. [Crossref] [PubMed]
- Herrera-Almario G, Patane M, Sarkaria I, et al. Initial report of near-infrared fluorescence imaging as an intraoperative adjunct for lymph node harvesting during robot-assisted laparoscopic gastrectomy. J Surg Oncol 2016;113:768-70. [Crossref] [PubMed]
- Chao YK, Hsieh MJ, Liu YH, et al. Lymph Node Evaluation in Robot-Assisted Versus Video-Assisted Thoracoscopic Esophagectomy for Esophageal Squamous Cell Carcinoma: A Propensity-Matched Analysis. World J Surg 2018;42:590-8. [Crossref] [PubMed]
- Matsuda S, Takeuchi H, Kawakubo H, et al. Clinical outcome of transthoracic esophagectomy with thoracic duct resection: Number of dissected lymph node and distribution of lymph node metastasis around the thoracic duct. Medicine 2016;95:e3839. [Crossref] [PubMed]
- Oshikiri T, Takiguchi G, Miura S, et al. Thoracic Duct Resection During Esophagectomy Does Not Contribute to Improved Prognosis in Esophageal Squamous Cell Carcinoma: A Propensity Score Matched-Cohort Study. Ann Surg Oncol 2019;26:4053-61. [Crossref] [PubMed]
- Liu K, Zhang GC, Cai ZJ. Avoiding anastomotic leakage following esophagogastrostomy. J Thorac Cardiovasc Surg 1983;86:142-5. [Crossref] [PubMed]
- Goldsmith HS, Kiely AA, Randall HT. Protection of intrathoracic esophageal anastomoses by omentum. Surgery 1968;63:464-6. [PubMed]
- Zhang K, Yang YH. Use of pedicled omentum in oesophagogastric anastomosis: analysis of 100 cases. Ann R Coll Surg Engl 1987;69:209-11. [PubMed]
- Germain A, Bresler L. Robotic-assisted surgical procedures in visceral and digestive surgery. J Visc Surg 2011;148:e40-6. [Crossref] [PubMed]
- Ruurda JP, van Vroonhoven TJ, Broeders IA. Robot-assisted surgical systems: a new era in laparoscopic surgery. Ann R Coll Surg Engl 2002;84:223-6. [Crossref] [PubMed]
- Plat VD, Stam WT, Schoonmade LJ, et al. Implementation of robot-assisted Ivor Lewis procedure: Robotic hand-sewn, linear or circular technique? Am J Surg 2020;220:62-8. [Crossref] [PubMed]
- Luketich JD, Pennathur A, Awais O, et al. Outcomes after minimally invasive esophagectomy: review of over 1000 patients. Ann Surg 2012;256:95-103. [Crossref] [PubMed]
- Weksler B, Sharma P, Moudgill N, et al. Robot-assisted minimally invasive esophagectomy is equivalent to thoracoscopic minimally invasive esophagectomy. Dis Esophagus 2012;25:403-9. [Crossref] [PubMed]
- Hernandez JM, Dimou F, Weber J, et al. Defining the Learning Curve for Robotic-assisted Esophagogastrectomy. J Gastrointest Surg 2013;17:1346-51. [Crossref] [PubMed]
- Zhang H, Chen L, Wang Z, et al. The Learning Curve for Robotic McKeown Esophagectomy in Patients With Esophageal Cancer. Ann Thorac Surg 2018;105:1024-30. [Crossref] [PubMed]
- Sarkaria IS, Rizk NP, Grosser R, et al. Attaining Proficiency in Robotic-Assisted Minimally Invasive Esophagectomy While Maximizing Safety During Procedure Development. Innovations (Phila) 2016;11:268-73. [Crossref] [PubMed]
- van der Sluis PC, Ruurda JP, van der Horst S, et al. Learning Curve for Robot-Assisted Minimally Invasive Thoracoscopic Esophagectomy: Results From 312 Cases. Ann Thorac Surg 2018;106:264-71. [Crossref] [PubMed]
- Hardwick RH. The Association of Upper Gastrointestinal Surgeons (AUGIS) and the Association of Laparoscopic Surgeons (ALS) of Great Britain & Ireland. A Consensus View and Recommendations on the Development and Practice of Minimally Invasive Oesophagectomy. September 2009, AUGIS, 2011. Available online: http://www.augis.org
- Tapias LF, Morse CR. Minimally invasive Ivor Lewis esophagectomy: description of a learning curve. J Am Coll Surg 2014;218:1130-40. [Crossref] [PubMed]
- Grimminger PP, van der Sluis PC, Stein H, et al. Feasibility of Transcervical Robotic-Assisted Esophagectomy (TC-RAMIE) in a Cadaver Study—A Future Outlook for an Extrapleural Approach. Appl Sci 2019;9:3572. [Crossref]
- Predina JD, Okusanya O, D, Newton A, et al. Standardization and Optimization of Intraoperative Molecular Imaging for Identifying Primary Pulmonary Adenocarcinomas. Mol Imaging Biol 2018;20:131-8. [Crossref] [PubMed]

张仁泉
主任医师,副教授,科主任,博士生导师。中华医学会胸心血管外科学分会食管疾病学组委员;中国医师协会胸外科分会委员;国际食管疾病学会中国分会(CSDE)委员;世界华人医师协会胸部肿瘤专业委员会常委;中国抗癌协会食管癌专业委员会委员;中国医疗保健国际交流促进会胸外科分会委员;中国医疗保健国际交流促进会胸外科分会胸腔内镜新技术应用推广学组副组长;中国抗癌协会纵隔肿瘤专委会常委;安徽省第六周期学术技术带头人;安徽省医学会胸外科学会候任主委;安徽省医师协会胸外科分会副主任委员;安徽省沿淮肿瘤综合防治项目及消化道肿瘤早诊早治项目专家。(更新时间:2021/6/2)

段晓峰
主治医师,医学博士,就职于天津医科大学肿瘤医院食管肿瘤微创外科。现担任吴阶平医学会模拟医学部胸外科专委会青年委员,天津市中西医结合学会临床营养治疗专委会青年委员,国际食管疾病协会(ISDE)会员,中国抗癌协会会员;同时担任《中华胸部外科电子杂志》中青年编委,Annals of Thoracic Surgery等SCI杂志审稿专家。2017—2018年赴美国南卡罗莱纳州医科大学癌症中心访问学习。主持多项国家级及省部级课题。发表国内外学术论文30余篇。2020年CSCO UNDER35 优秀青年肿瘤医生。参编、参译《食管外科》《食管癌诊断和治疗》等著作。(更新时间:2021/6/2)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Ekeke CN, Luketich JD, Sarkaria IS. Robotic-assisted minimally invasive esophagectomy. Ann Esophagus 2021;4:7.