
贲门失弛缓症引发食管癌风险研究
前言
19世纪70年代首次研究发现,长期贲门失弛缓症患者患食管癌的风险比一般人群高50倍[1]。然而由于缺乏强有力的流行病学证据及未能证明常规内镜检测策略能够提高生存率,之前的国际指南未推荐对贲门失弛缓症患者进行食管恶性肿瘤筛查[1-3]。本综述将探讨相关病理生理学内容,并回顾最新流行病学证据,以确定风险并指导临床工作中的决策。
病理生理学
贲门失弛缓症主要在慢性食管炎基础上发展成食管鳞状细胞癌,这一发展也与Barrett食管化生和食管腺癌有关,尽管不是很常见[4]。发展为恶性肿瘤的病理生理学的原因可能是多元的,两种组织学亚型之间可存在重叠[5,6]。
首先,食管中食物和唾液的淤滞会导致细菌过度生长、发酵并化学刺激食管上皮细胞。其次,这种炎症过程会导致慢性增生性食管炎,并易发生异型增生,最终发展成食管鳞状细胞癌 [5-7]。在长期贲门失弛缓症患者中,这种慢性食管炎的患病率很高,其中一组报告,在接受Heller手术五年或更长时间后接受内镜评估的患者中,有83%的患者获得病理确诊[8]。
贲门失弛缓症患者即使接受治疗,也可能患上慢性食管炎,其治疗方案主要针对容易引起胃食管反流病和巴雷特食管化生的食管下括约肌问题[6]。事实上,对欧洲贲门失弛缓症患者的长期随访研究表明,在接受腹腔镜 Heller手术治疗的患者组中,有34%的患者胃酸异常(pH值在超过4.5%的时间里低于4)[9]。荷兰对331名接受充气扩张治疗的贲门失弛缓症患者进行了一项单中心队列研究,其中28名(8.4%)患者接受近9年随访后,被诊断患有Barrett食管化生[10]。这些患者接受治疗后,食管下括约肌压力低于无Barrett食管化生的患者(13.9vs17.4 mmHg;P=0.03),这一数据表明治疗成功的患者更容易发生胃食管反流和Barrett食管化生。一项有趣的发现表明,患有相关食管裂孔疝的患者,与无相关食管裂孔疝的患者相比,患上Barrett食管化生的可能性要高出7倍[HR=8.04,95%(CI):3.5–18.1] [10]。
流行病学
观察性研究的荟萃分析
超过40项观察性研究报告了食管癌与贲门失弛缓症之间的关联[4]。2019年一项荟萃分析包括16项追踪贲门失弛缓症随访时长和持续时间的研究,Gillies等人报告说贲门失弛缓症患者食管癌的发病率为1.36/1 000患者年(95% CI:0.56–2.51)比国际癌症研究机构报告的一般人群发病率高10倍以上[11]。2017年,Tustumi等人根据组织学亚型对他们的荟萃分析进行分层,称鳞状细胞癌的发病率是312.4/100 000患者年,腺癌的发病率是21.23/100 000患者年,相对风险比分别为72.65和6.63[4]。独立汇总分析之间的差异是显而易见的。后一项荟萃分析仅包括13项研究,其中两项研究因队列重复而被排除在先前的分析之外。然而,这两项荟萃分析仍存在局限性,因为纳入了历史回顾性队列研究的数据。更具体地说,上述荟萃分析局限性包括:数据通常来自单个机构、随访时间相对较短、潜在的选择偏倚,以及大量病例失访[12]。
基于人群的当代队列研究
最近一项基于人群的队列研究涉及英国健康改善网络(THIN)数据库中的2 369例贲门失弛缓症病例和3 865例对照病例,该研究预测食道癌的风险为1.0/1 000患者年[13],与对照组相比,相当于5.22倍的发病率。THIN中的数据具有实际代表性,而且是基于人群的,因为包含一组覆盖6%英国人口的基层医疗数据。因此,贲门失弛缓症患者患食管癌的风险较高得到了有力证实,然而,实际风险比可能更高,因为考虑到从患者被诊断为贲门失弛缓症到发展成为食管癌的中位时间超过15年,而随访时间很短(平均6.1患者年);并且英国普通人群的食管癌发病率高于其他国家。
最近来自英国的另一项基于人群的队列研究参考了医院事件统计(HES)数据库。根据HES的数据,2002年到2012年间被诊断为贲门失弛缓症并接受治疗的患者共有7 487名[14]。该数据库利用管理数据来追踪英格兰所有公立医院和私立医院。在上述队列中,101名患者(1.3%)发展为食管癌。食管癌的发病率为205/100 000患者年,相当于15.19的发病率比。患者从最初接受治疗到发展为癌症的中位时间仅为3年(范围极值是1~11年)。随后对该贲门失弛缓症队列进行的病例对照分析表明发展为食管癌的患者年龄较大(>80岁组对比<40岁组,HR =18.71,95% CI:4.30–81.44),而且他们接受的主要治疗方法是气动扩张治疗(82.2%与60.3%;HR =2.27,95% CI:1.03–5.03)[14]。不过要重点强调的是,后一种关联可能有年龄因素带来的干扰,因为随着年龄的增长,更大比例的患者会接受气动扩张治疗而不是Heller手术[15]。
最后,还有一项大规模人群队列研究值得关注,该研究包括1965—2003年2 896名在瑞典住院登记册中出院诊断为贲门失弛缓症的患者[16]。与前两项研究不同,前文提到的荟萃分析包含了该队列的数据。该队列有完整的癌症、死亡原因和转移记录。去除第一年随访记录以排除已患食管癌的病例,鳞状细胞癌标准化发病率(简称SIR,与瑞典人群对照组进行年龄、性别和历年的匹配)为11.0(95% CI:6.0-18.4),腺癌SIR为10.4(95% CI 3.8-22.6)。该队列中的癌症数量很少(n = 22),因此对所有分层分析的解释应严谨。然而,随着随访时间的延长(2—9年),食管癌病例主要见于男性(n=20)且没有证据表明鳞状细胞癌的发病率更高(2—9年,SIR=11.1,95%CI:5.1–21.1vs10—38年SIR=10.8,95%CI:3.5–25.1)[16]。
临床表现与预后
由于吞咽困难症状的加重通常考虑是贲门失弛缓症复发或恶化,所以食管癌通常会出现延误诊断的情况[17]。肿瘤最终必须大到足以阻塞扩张的食道或出现上消化道出血,才能帮助确诊[18,19]。因此,发现食管癌时,肿瘤往往处于更晚期的阶段,并且预后较差。根据之前的预测,多达80%的贲门失弛缓症和食道癌患者并没有获得确定性处理[18]。根据Tustum等人的荟萃分析,只有4.54%的患者存活时间超过5年,平均存活时间为12.7个月[4]。相比之下,食管癌的全球五年生存率介于15%~25%之间[20]。
内镜监测
支持观点与反对观点
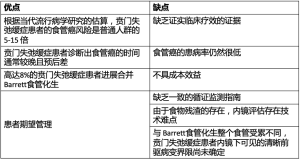
内镜监测在贲门失弛缓症患者中的作用仍存在争议,尚无共识[17]。一方面,上述基于人群的观察数据表明,贲门失弛缓症患者患食管癌的风险是一般人群的5~15倍[13,14,16]。由于症状出现较晚,贲门失弛缓症患者的食管癌预后不良,因此更有必要定期监测患者,争取在早期阶段诊断出食管恶性肿瘤。然而,荷兰的一项机构监测计划(白光内镜检查)中,448名贲门失弛缓症患者的食管癌死亡率与一般人群的预期死亡率相似[21]。值得注意的是,对长期或未完全接受治疗的贲门失弛缓症患者做内镜监测可能很困难,因为不像Barrett食管化生的患者整个食道都受累,而贲门失弛缓症患者的黏膜常被食物残渣覆盖,随机活检可能不具有代表性[17]。最后要考虑的问题是食管癌的发病率低,因此为所有贲门失弛缓症患者提供常规监测的成本效益是值得怀疑的[17]。表1总结了内镜监测的利弊。
Full table
白光内镜与鲁氏碘染色内镜的效果
为了提高监测的效果,一些作者提出使用染色内镜筛查异型增生。染色内镜中含有正常糖原的食道黏膜会呈现棕绿色,异型增生病灶缺乏糖原,不会变色,从而能够更有效观察到病灶[5]。在欧洲两个三级转诊中心接受治疗的230名贲门失弛缓症患者队列中使用该技术后,疑似病灶的检出率提升了两倍(白光内窥镜检出111个病灶,染色内视镜检出329个病灶)。然而,这些病变中只有8%的组织病理学证实为食管鳞状细胞癌或低度不典型增生[5]。该队列中的贲门失弛缓症患者接受了内窥镜监测,每三年进行一次白光和染色内镜检查。中位随访12年后,只有三名患者恶化为鳞状细胞癌,并且这些患者均未出现异型增生。同样,四名患者被诊断为低度不典型增生,中位随访9年后未恶化为高度不典型增生或侵袭性恶性肿瘤[5]。基于以上结果,不能系统性使用白光或染色内镜来监测贲门失弛缓症患者的食管癌进展,因为这两种方法都不能准确识别前驱病变。
阿德莱德一项横断面研究的数据也佐证了以下论点,即可能没有必要对所有贲门失弛缓症患者进行常规内镜监测[8]。这项研究从171名接受Heller手术治疗的前瞻性患者数据库中选取了68名患者,进行一次内镜评估。虽然入组患者中83%有食管炎组织学证据,7%有Barrett食管化生,但在至少五年的随访后,没有患者出现不典型增生或侵袭性恶性肿瘤[8]。在171名患者的主要队列中,2名患者死于食管鳞状细胞癌,这是在Heller手术后8年和10年确诊的。个别研究表明,在出现症状超过10年或行Heller手术5年后,食管癌风险似乎较为明显。许多作者认为,如果在这些时间之后实施监测可能会更有效[5,8,17]。但我们应谨慎解释此类阈值,尤其是英国基于人群的新数据表明,初始治疗开始仅3年,癌症风险就会过高[14]。
对高危患者的针对性监测
如前所述,更具针对性的监测可能适用于老年患者[14]和男性[16]所代表的亚组。因为食物也许会滞留在不动的食管中,食管扩张的患者也可能属于高风险组。事实上,意大利对583名贲门失弛缓症患者进行了队列研究,发现无论是接受治疗前食管扩张的患者(诊断时食管直径>71 mm,HR=21.07,95% CI:9.29–47.82),还是终末期贲门失弛缓症和乙状结肠形食管患者(HR=17.64,95% CI:4.13–75.43)[19],患食管癌的风险都更高。然而,迄今为止,对这些患者进行针对性筛查的相关数据不足,因此不能推广。
成本-效益分析
最后,应仔细考虑任何监测计划的成本效益。对Barrett食管化生患者转为恶性肿瘤的监测已经普及,但在癌症发生率为0.5%的不伴异型增生的Barrett食管患者,每五年检测一次才具有成本效益[22]。当癌症的发病率较低时,监测的有效性受到进一步质疑。尽管贲门失弛缓症患者患食管癌的风险增加,但总体风险仍然很低[17]。在一组贲门失弛缓症患者(n=448)中,恶性转化的年发生率为0.34%。该发生率仅略低于Barrett食管化生患者中腺癌的0.5%~1.0%,因此人们提倡对贲门失弛缓症患者做定期监测[21]。然而一项更接近当代且规模更大的人群研究(n=7,487)发现,贲门失弛缓症患者恶性进展的等效年发生率仅为0.21%[14]。鉴于发病率较低,对所有患者进行常规监测的成本效益仍然值得怀疑[12]。由于缺乏证实内镜监测有效性的数据,推广常规性监测进一步受到阻碍[23]。
国际指南缺乏共识
由于上述原因,国际食管疾病学会(ISDE)[1]、美国胃肠内镜学会(ASGE)[2]和美国胃肠病学会(ACG) [3]当下的指南不推荐对贲门失弛缓症患者做内镜常规监测。不过欧洲胃肠内镜学会(ESGE)的立场声明却截然相反,只是没有详细说明此类监测的时间或频率[22]。ISDE 2018年的指南建议告知贲门失弛缓症患者他们患食管癌的风险有中度增加,尤其是对于距离初次治疗已有至少10年的男性患者。该指南没有提出经过任一治疗后接受常规内镜监测或有关监测时间间隔的具体要求[1]。不过还是应该重点提醒患者,总体风险仍然很低。
ISDE指南认为可以在个体患者的基础上进行内镜检查,而ASGE建议“如果考虑进行监测,则在症状出现15年后开始监测是合理的。”[2]。因此,虽然大多数指南不推荐监测,但各指南仍旧有潜在争议[12]。事实上,一项新的全球调查咨询了16位贲门失弛缓症专家,发现各地识别癌症风险以及后续筛查的方法不一致[23]。具体来说,调研对象中有3名专家认为与一般人群相比,贲门失弛缓症患者患食管癌的风险没有增加;8名专家认为上述患者的终生风险为0.1%~0.5%;3名专家认为风险为0.5%~1%;2名专家认为风险为1%~2%;1名专家认为风险为3%~5%。筛查时间点也各不相同,在诊断后1年(n=2)、5年(n=3)或10年(n=3)内开始。监测间隔也从2年到5年不等。
总结
流行病学证据证实,贲门失弛缓症患者的食管癌风险的确会增加,估计现代发病风险比在5到15之间。不幸的是,贲门失弛缓症患者食管癌的预后很差,可能继发于慢性扩张性食管患者的延迟就诊。目前没有针对此类病症的统一临床处理方法,但根据基于人群的队列研究,贲门失弛缓症患者食管癌恶变的风险似乎低于Barrett食管化生患者。再加上常规内镜评估缺乏有效性,大多数指南不推荐内镜监测。然而,许多研究表明,某些群体的风险更高,如男性、老年患者、食管扩张患者和伴有长期症状的人群。然而迄今为止,对这些患者进行针对性筛查的数据不足,因此还不能推广。在公立医疗保健系统中,不建议进行常规内镜监测。临床医生个人应该对恶化的症状保持警惕,并及时进行内镜检查,协助早期诊断出恶变[14]。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Sarah Thompson) for the series “Achalasia” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: The author has completed the ICMJE uniform disclosure form (available at: http://dx.doi.org/10.21037/aoe-2019-ach-11). The series “Achalasia” was commissioned by the editorial office without any funding or sponsorship. The author has no other conflicts of interest to declare.
Ethical Statement: The author is accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Zaninotto G, Bennett C, Boeckxstaens G, et al. The 2018 ISDE Achalasia guidelines. Dis Esophagus 2018;31:1-29. [Crossref] [PubMed]
- Evans JA, Early DS, Fukami N, et al. The role of endoscopy in Barrett’s esophagus and other premalignant conditions of the esophagus. Gastrointest Endosc 2012;76:1087-94. [Crossref] [PubMed]
- Vaezi MF, Pandolfino JE, Vela MF. ACG clinical guideline: Diagnosis and management of achalasia. Am J Gastroenterol 2013;108:1238-49. [Crossref] [PubMed]
- Tustumi F, Bernardo WM, da Rocha JRM, et al. Esophageal achalasia: A risk factor for carcinoma. A systematic review and meta-analysis. Dis Esophagus 2017;30:1-8. [Crossref] [PubMed]
- Ponds FA, Moonen A, Smout AJPM, et al. Screening for dysplasia with Lugol chromoendoscopy in longstanding idiopathic Achalasia. Am J Gastroenterol 2018;113:855-62. [Crossref] [PubMed]
- Nesteruk K, Spaander MCW, Leeuwenburgh I, et al. Achalasia and associated esophageal cancer risk: What lessons can we learn from the molecular analysis of Barrett’s-associated adenocarcinoma? Biochim Biophys Acta Rev Cancer 2019;1872:188291 [Crossref] [PubMed]
- Leeuwenburgh I, Haringsma J, Van Dekken H, et al. Long-term risk of oesophagitis, Barrett’s oesophagus and oesophageal cancer in achalasia patients. Scand J Gastroenterol Suppl 2006;41:7-10. [Crossref] [PubMed]
- Gossage JA, Devitt PG, Watson DI, et al. Surveillance endoscopy at five or more years after cardiomyotomy for achalasia. Ann Surg 2014;259:464-8. [Crossref] [PubMed]
- Moonen A, Annese V, Belmans A, et al. Long-term results of the European Achalasia trial: A multicentre randomised Controlled trial comparing pneumatic dilation versus laparoscopic Heller myotomy. Gut 2016;65:732-9. [Crossref] [PubMed]
- Leeuwenburgh I, Scholten P, Caljé TJ, et al. Barrett’s esophagus and esophageal adenocarcinoma are common after treatment for achalasia. Dig Dis Sci 2013;58:244-52. [Crossref] [PubMed]
- Gillies CL, Farrukh A, Abrams KR, et al. Risk of esophageal cancer in achalasia cardia: A meta-analysis. JGH Open 2019;3:196-200. [Crossref] [PubMed]
- Eckardt AJ, Eckardt VF. Editorial: Cancer surveillance in achalasia: Better late than never. Am J Gastroenterol 2010;105:2150-2. [Crossref] [PubMed]
- Harvey PR, Thomas T, Chandan JS, et al. Incidence, morbidity and mortality of patients with achalasia in England: Findings from a study of nationwide hospital and primary care data. Gut 2019;68:790-5. [Crossref] [PubMed]
- Markar SR, Wiggins T, MacKenzie H, et al. Incidence and risk factors for esophageal cancer following achalasia treatment: national population-based case-control study. Dis Esophagus 2019;32:1-7. [Crossref] [PubMed]
- Markar SR, Mackenzie H, Askari A, et al. Population-based cohort study of surgical myotomy and pneumatic dilatation as primary interventions for oesophageal achalasia. Br J Surg 2018;105:1028-35. [Crossref] [PubMed]
- Zendehdel K, Nyrén O, Edberg A, et al. Risk of esophageal adenocarcinoma in achalasia patients, a retrospective cohort study in Sweden. Am J Gastroenterol 2011;106:57-61. [Crossref] [PubMed]
- Boeckxstaens GE, Zaninotto G, Richter JE. Achalasia. Lancet 2014;383:83-93. [Crossref] [PubMed]
- Meijssen MAC, Tilanus HW, Van Blankenstein M, et al. Achalasia complicated by oesophageal squamous cell carcinoma: A prospective study in 195 patients. Gut 1992;33:155-8. [Crossref] [PubMed]
- Tassi V, Lugaresi M, Mattioli B, et al. Incidence and risk factors for the development of epidermoid carcinoma in oesophageal achalasia. Eur J Cardiothorac Surg 2019;55:956-63. [Crossref] [PubMed]
- Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359-E386. [Crossref] [PubMed]
- Leeuwenburgh I, Scholten P, Alderliesten J, et al. Long-term esophageal cancer risk in patients with primary achalasia: A prospective study. Am J Gastroenterol 2010;105:2144-9. [PubMed]
- Săftoiu A, Hassan C, Areia M, et al. Role of gastrointestinal endoscopy in the screening of digestive tract cancers in Europe: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2020;52:293-304. [Crossref] [PubMed]
- Ravi K, Geno DM, Katzka DA. Esophageal cancer screening in achalasia: Is there a consensus? Dis Esophagus 2015;28:299-304. [Crossref] [PubMed]

周卧龙
中南大学湘雅医学院本科毕业,中南大学湘雅医院胸外科硕士、博士毕业,美国贝勒医学院(Baylor College of Medicine)联合培养2年。长期从事胸外科肺癌、食管癌的基础与临床研究,对食管疾病相关的临床研究与外科技术进展有浓厚的兴趣。(更新时间:2021/8/1)

程净革
医学硕士,河北医科大学第四医院胸外主治医师,长期从事胸外科常见病诊疗工作,主要研究方向:食管癌及肺癌的综合治疗。近3年发表论文3篇,主要集中在食管癌和肺癌的综合治疗方面。(更新时间:2021/8/25)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Gray RT. Esophageal cancer risk in achalasia. Ann Esophagus 2020;3:33.


