
胃食管交界处腺癌:集中化总是一个好主意吗?
简介
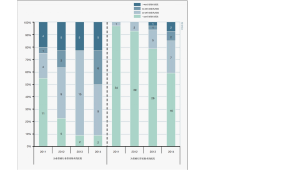
食管癌是全球第七大最常见的恶性肿瘤,也是全球第六大最致命的恶性肿瘤 [1]。治愈性治疗通常包括新辅助放化疗和食管切除术,这是一种具有相当高发病率的侵入性手术。据报道,荷兰食管癌手术的术后并发症发生率高达65% [2]。大量研究表明,手术量、医院容量和外科医生数量是影响食管切除术等高风险、低发生率的肿瘤手术后预后的重要决定因素[3-6]。这些研究导致荷兰于2011年引入了食管癌手术量标准。根据荷兰指南,目前医院每年至少进行20次食管切除术[7]。2014年荷兰上消化道癌症审计对荷兰上消化道癌症手术的进行性集中化趋势进行了分析(图1)[8,9],显示2014年低容量医院(每年21次食管切除术)的数量与上一次 2007 年的调查[10]相同。在来自49个国家的478名受访者中,大手术量外科医生的比例从45%上升到54%。然而,关于集中化的文献报道并不明确。几位调查手术量和手术预后之间关系的作者发现了相反的结果[11,12]。Gillison等人的一项基于人群的研究发现,30天死亡率或长期生存率的改善与外科医生工作量的增加之间没有关联 [11]。此外,大多数关于集中化的证据一般集中在食管癌上。关于胃食管交界处(GEJ)癌的医院规模与预后关系的文献很少。GEJ 肿瘤的最佳分期策略和手术治疗更加难以确定,因为食管切除术和胃切除术都是可行的选择 [13,14]。第八版 TNM 分期将Siewert Ⅲ交界处肿瘤归类为胃癌,从而扭转了早期将Siewert Ⅲ归类为食管癌的定义[15-17]。这一争议表明,交界性肿瘤的分期和治疗应该因病因人而异。因此,交界性肿瘤可能需要更大规模的诊治中心及经验更丰富的临床医生。
鉴于在该领域内仍有诸多争议,本研究旨在回顾有关多学科GEJ癌症诊治多个方面的集中化的现有文献。
诊断
在荷兰,地区医院通常会在转诊到外科专家之前进行术前检查。转诊后,影像会在专家中心重新评估,但并不总会复查。此外,假阴性的患者将不会被转诊。对于远处转移假阳性的患者,也可能会被拒绝转诊至外科专家诊所[18]。关于在小规模或非专家中心对GEJ癌症进行分期的影响的研究证据很少。然而,一些研究探索了食管癌总体上的诊断的医院规模与预后的关系。一项亚洲研究发现,观察者间信度与医院内窥镜检查量或内窥镜医生经验无关 [19]。该研究纳入的内窥镜医生来自7个亚洲中心,他们至少有5年的内窥镜操作经验,至少1 000次内窥镜检查经验。通过视频培训后,无论医院内窥镜检查量或内窥镜医生数量如何,GEJ部位的评估或疑似Barret食管的分级在不同观察者间信度都很高。2006年发表的一项荷兰研究比较了61个区域食管癌诊断中心与每年治疗约120名食管癌患者的专科诊疗中心术前对远处转移检测的质量[20]。专科医院并不总是复查影像,而是总是重新评估原有的影像结果。该研究纳入了1 088名患者,其中41%患有GEJ癌,但没有报告交界处肿瘤的独立的结果。总体而言,地区医院CT扫描检测区域淋巴结转移和远处转移的敏感性分别为26%和44%。中心专科医院分别为52%和84%(P<0.01)。在专科中心,通过超声检测颈部淋巴结转移的敏感性也更高(26%vs84%)。地方和专科医院的影像学检测的特异性相当。结合所有诊断方式,专科中心在13%的患者中检测到被地方医院遗漏的转移。这将影响治疗计划的制定。这项研究的结果表明,专业、经验丰富的放射科医生非常重要,然而,专科医院使用的更高水平的CT扫描仪也是必不可少的[21]。同一团队的另一项研究得出,由低手术量的内镜医生(<50EUS/年)进行的内窥镜超声检查(EUS)的结果不如高手术量的内镜医生准确 [22]。这表明EUS应该集中并由有经验的专科内窥镜医生执行,以优化食管癌分期。另一项来自英格兰的研究,纳入了交界处肿瘤(结果未单独报告)以及食道癌和胃癌,发现与由低手术量医生治疗的患者相比,高手术量医学专家诊治的患者接受了更多的诊断性影像学检查[23]。在纠正可能的混杂因素后,这导致高手术量外科医生进行的可避免手术(开-关手术)率显著降低,更表明了精准分期的重要性。
上述研究的结果表明,食管癌的分期应该由专门的、专业的放射科医生和内窥镜医生在大规模的专科中心进行。这尤其适用于GEJ肿瘤,因为分期的细微差异(例如,Siewert Ⅱ与 Siewert Ⅲ)可能会极大地影响治疗决策。
Barrett食管或早期癌症的内镜治疗
荷兰指南提倡对伴有不典型增生或早期癌症的Barret食管进行集中化的内镜治疗[24]。该指南将Barret的专病中心指定为:(Ⅰ)每年至少有10名不典型增生或早期癌症患者由一名专门的内窥镜医生进行内窥镜治疗;(Ⅱ)所有组织学病理均由最多两名专职病理学家进行评估;(Ⅲ)包括上消化道外科医生和肿瘤学家在内的多学科团队(MDT)讨论了所有Barret相关癌症的病例;(Ⅳ)拥有最先进的高分辨率内窥镜,以及(Ⅴ)可治疗并发症(如穿孔或出血)的设施。美国胃肠病学协会(AGA)的国家指南也将每年最小内镜治疗量设定为10[25]。来自英国胃肠病学会的英国指南则提出了每年进行至少15次内镜治疗的规模标准[26]。这些标准的提出基于一项2012年发表的荷兰研究和最近的一项亚洲研究[27,28]。这项荷兰研究评估了6名内窥镜医生在经过结构化和密集的实践培训计划后进行的前120次内窥镜切除术的结果。他们发现,每位内镜医生执行的前20次切除术的穿孔率为5%,这反映了手术的复杂性。此外,在完成20次切除术后仍未达到学习曲线的峰值[27]。第二项研究纳入了430名接受Barret食管射频消融的患者。研究发现,与低消融量医院(年消融<3次)相比,每年10次或更高的消融量与显著较低的复发率相关[28]。
由于早期肿瘤征兆是不易察觉的,最先进的内窥镜技术,以及经验足够的内窥镜医生和病理学家是必要的。此外,考虑到内镜切除术可能出现的并发症,建议选择具有手术条件和内镜治疗并发症处理经验的专家中心。因此,将Barret食管和早期癌症诊治集中在经验丰富的食管切除术专科中心是合乎逻辑且有效的。
手术治疗——医院规模
短期和长期手术预后
关于食管切除术的医院手术量与手术预后之间关系的文献很多。一项纳入了16项高质量研究(使用多变量逻辑回归报告病例混合校正结果的多中心研究)的荟萃分析发现,低手术量医院的术后死亡率(优势比2.30,95%置信区间:1.89—2.80)显著升高[29]。此外,他们发现在小规模医院中患者术后的长期生存期较短。由于这项荟萃分析汇集了所纳入研究的所有高手术量和低手术量医院,因此不同高手术量医院进行的手术数量不同。高手术量医院的定义范围从每年2.33次到多达87次食管切除术。另一项纳入13项研究的荟萃分析发现,与中等和低手术量医院(分别为11~20和≤10例食管切除术/年)相比,每年20次或更多食管切除术的医院与较低的术后死亡率相关[5]。他们还发现,在高手术量医院,并发症发生率更低,长期生存率更高。第三项荟萃分析支持这些结论[30]。在这项荟萃分析中,高手术量医院被定义为每年进行18次或更多食管切除术的医院。它得出结论,必须将10名患者从低手术量医院转诊到高手术量医院,才能防止一例术后死亡。该荟萃分析还发现,医院规模与胃切除术的短期和长期生存率之间存在显著的负相关。另一项使用CRITICS(胃癌诱导化疗后化疗)试验数据的研究纳入了494名患者[31]。它得出结论,在高手数量医院(每年胃切除术超过21次)中,胃切除术后总体生存率和无病生存率更高。
高手术量医院诊治病例的更好的长期生存率可能与这些中心进行更广泛的肿瘤切除有关。几项研究发现,在高手术量医院进行食管切除术和胃切除术时,淋巴结清扫量更高[32-35]。食管切除术清扫淋巴结超过15个的患者所占比例在低手术量医院为29%~47%,在高手术量医院则为44%~76%。对于胃切除术,一项荷兰研究分析了来自 CRITICS 的数据,发现高手数量医院(每年进行31次或更多胃切除术)的淋巴结清扫准确度更高。在高容量医院中食管切除术和胃切除术的长期生存率更高的另一个原因可能是据报道根治率更高[36-38]。另一个假设是,在高手术量医院食管切除术后较低的术后死亡率或较好的长期生存率是由于抢救失败率低。高手术量医院更能够快速识别和有效管理术后发病症[39-41]。在这些研究中,抢救失败率在规模最小的医院中为20%~30%,而在规模最大的医院中为12%~13%。
一些研究使用复合年度医院规模而不是年度食管切除术量[42-44]。一项纳入4,837名胃癌患者的荷兰研究发现,每年复杂的上消化道手术(食管切除术、胃切除术和胰腺手术)与术后死亡率之间存在关联[42]。大规模医院每年进行40次或更多复杂的上消化道切除术。另一个有趣的发现是老年人(75岁及以上)从大规模中心的手术中获益最多,这表明转诊到大规模中心对于病情复杂或体弱的患者尤其必要。Coupland等人的一项英国研究也使用了复合规模的标准(食管切除术和胃切除术的数量/年)。进行超过80次手术的医院被认为是大手术量。在对混杂因素进行校正后,他们发现在大规模中心的短期死亡率更低,1年总生存率更高[43]。
集中化应该走多远?
Leapfrog协作组是最早建立手术量标准的组织之一 [45]。他们建议每年进行7次食管切除术的食管切除术规模标准。另一项纳入了1,634名食管切除术患者的研究试图验证Leapfrog提出的手术量标准 [46]。他们没有发现Leapfrog标准和术后死亡率之间有很强的关系。然而,他们确实发现每年22次食管切除术的阈值可作为术后死亡率的预测指标。另一项荷兰研究使用国家癌症登记处 (NCR) 的数据进行了良好的研究,试图为医院每年的食管切除术量定义一个有意义的阈值[47]。它纳入了10,025名接受切除的食管癌或GEJ癌患者。研究者发现医院手术量的增加与较低的6个月死亡率相关。然而,当医院每年进行超过60次食管切除术时,6个月死亡率的风险比就达到了平台期。2年总生存率也出现了类似的趋势:与小规模医院相比,大规模医院的生存率明显更高,但在手术量达到每年50次时达到了平台期。这些研究的结果表明,在某个阈值内而不是无限的情况下,集中化是必要的。第三项研究证实了这一结论,该研究发现术后死亡率随着医院手术量的增加而下降,但一旦年手术量超过100例,则再次上升[48]。
成本和集中化
几位研究者调查了接受食管癌手术的患者的医院规模与医院费用之间的关系。在美国进行的一项研究纳入了1990年至1994年间接受食道癌治疗的1 561名患者[49]。研究发现,与小规模医院(5年1~5次手术)相比,大规模医院(5年超过30次手术)的总医院成本更高。然而,更多的患者从大规模医院出院回家,而患者在小规模医院切除后更多地转诊到中级护理机构。这具有显著的经济影响,但该研究并未对此进行量化。Swisher等人的一项研究,纳入了340名食管切除术患者发现了相互矛盾的结果[50]。经过校正混杂因素后,大规模医院(每年进行超过5次食管切除术)的医院成本显著降低。这种差异可能归因于Swisher等人在大规模医院中发现的较低的并发症发生率和较短的住院时间。另一项美国的研究发现,大规模医院和小规模医院(以每年进行6次食管切除术区分)的医院成本相当[51]。除了大规模医院的死亡率较低之外,他们还发现大规模医院的住院时间和住重症监护病房(ICU)时间更短。然而,这并没有降低医院成本。此外,他们发现大规模医院有更多的出院后直接回家的病例,但他们没有报告其经济影响。
关注GEJ肿瘤的文献
前面讨论的研究没有报告GEJ癌的单独结果。日本随机对照试验JCOG9502的一项衍生研究仅纳入了GEJ癌并调查了医院规模与预后的关系[52]。JCOG9502纳入了来自21家医院的157名患者,并将所有患者在通过左胸腹入路和经裂孔腹部入路的全胃切除术之间随机分配[53]。作者发现更大的医院规模与更少的术中失血量有关。他们发现医院规模与清扫淋巴结数量、手术时间、发生术后并发症的患者数量和总生存率之间没有关联。然而,所有纳入医院的年度胃切除术量均可以认为是很高的,因为它的范围是44~511。德国的一项研究纳入了108家医院的544名GEJ肿瘤患者 [54]。与其他规模组相比,3年内交界处肿瘤的病例数为11~20个的医院使用新辅助治疗率显著更高[20]。他们没有报告术后预后与医院规模的关联。此外,他们只报告了GEJ癌的,而不是全食管切除术或胃切除术的结果。因此,在大规模医院接受治疗的患者比例较低。第三项苏格兰研究也报告了GEJ肿瘤的单独结果[55]。它纳入了206名交界处肿瘤的患者。大规模医院(每年切除35次以上)的术后死亡率为0%,而在小规模医院(<35例)中为8.1%。然而,他们发现医院规模与长期生存率之间没有关联。在一项纳入555名患者的荷兰研究中,82.2%的患者患有GEJ或远端食管癌[36],研究发现大规模医院(每年切除10次以上)的患者有更多的合并症。尽管研究人群存在上述差异,但大规模医院的术后死亡率较低(6.3% vs. 2.9%)。此外,大规模医院的术后(手术)并发症显著减少,住院时间也明显缩短(小规模医院的中位数为22天,而大规模医院为14天)。未发现医院规模与长期生存之间存在关联。
这些关于GEJ肿瘤的研究结果并不明确支持集中化。然而,大多数研究发现医院规模对手术结果有一些积极影响。没有报告大规模医院的不良结果。此外,没有关于GEJ癌抢救失败与医院规模之间关联的文献,尽管这可能是医院规模与预后关系中的一个关键因素。
手术治疗——外科医生手术量
尽管研究外科医生手术量的文献不如研究医院手术量的文献丰富,但有几位作者研究了外科医生手术量与食管切除术后手术预后之间的关联。早在1997年就有研究探索了外科医生的手术量与预后关系 [56]。总共纳入了来自加拿大安大略省汉密尔顿地区癌症中心的74名食管切除术患者。食管切除术由20位不同的外科医生进行,其中3位是大手术量的外科医生(每年进行超过6次食管切除术)。大手术量的外科医生术后并发症率较低(0% vs. 22%)和吻合口瘘率较低(7% vs. 22%)。Sundelöf等人最近的一项研究纳入了232名患者(包括118名贲门癌)并研究了外科医生的手术量与预后的关系[57]。在他们的研究中,一位大手术量的外科医生每年至少进行10次食管切除术。他们发现,由高手术量外科医生进行手术的长期生存率更高。他们还发现,在大手术量外科医生中,短期内的手术预后也有更好的趋势,但并不显著。此外,他们还发现外科医生手术量和医院规模之间存在很大的相关性。2016年在英格兰进行的一项基于人群的研究,试图寻求以最小手术量获得最低的手术死亡率[58]。在对外科医生经验、医院类型和患者相关混杂因素进行适当的统计校正后,较高的外科医生数量是术后死亡率较低的重要预测因素。大手术量外科医生(每年12次食管切除术)的风险调整死亡率为2.96%,而小手术量外科医生(每年食管切除术<8 次)的风险调整死亡率为5.19%。使用CUSUM分析无法可靠地估计最佳外科医生的手术量。此外,该研究发现外科医生手术量和医院规模之间存在明显的重叠。对于胃切除术,也已经描述了类似的正向的的外科医生手术量与预后的相关趋势(58)。
几项研究发现了相反的结果。例如,先前讨论的JCOG9502试验,仅纳入交界处肿瘤,发现总生存期与外科医生手术量之间没有关联 [52]。他们仅发现大手术量外科医生在手术中清扫淋巴结数量有增加的趋势,而并不显著。此外,Gillison等人的一项研究,纳入了英国的1,125名患者发现长期生存率和术后死亡率与外科医生手术量之间没有关联(每年切除12次或以上的大手术量外科医生与每年进行4次或更少食管切除术的小手术量外科医生相比)[11]。
姑息性癌症治疗中的医院规模方面
据我们所知,有三项研究报告了姑息治疗中食管切除术医院的规模的影响。在HER2过度表达的转移性胃食管腺癌的全身治疗中加入曲妥珠单抗可延长总生存期和提高生活质量[59,60]。因此,一项全国性队列研究调查了HER2检测与医院规模之间的关系[61]。该研究纳入了2 846名患者,其中19.1%患有GEJ癌。根据2015年和2016年接受治疗的胃食管癌患者总数(<13、13~31、32~76 和>76),作者将医院分为四类。大规模医院比小规模医院明显更频繁地检测HER2过表达(88%vs68%;P<0.001)。此外,以全国中位数为分界对医院规模进行二分后,与小规模医院相比,大规模医院的总体生存率明显更好。这一结论得到了另一项荷兰的全国队列研究的支持,该研究还发现,在倾向评分匹配后,手术量和住院治疗量均较高的大规模医院治疗的转移性食管癌患者具有较高的生存优势[62]。他们发现大手术量和小手术量医院接受治疗的患者的中位生存期分别为10周和6周。作者称这是因为大规模医院拥有适当的、完善的设施,这是转移性食管癌复杂治疗所必需的。第三项研究得出了类似的结论[63]。它纳入了1 433名Ⅳ期胃癌患者,其中27%患有GEJ肿瘤。其中经验丰富的专家诊治的患者有着显著的生存获益。
结论
尽管大多数文献都表明集中化有积极影响,但关于集中化应该走多远很难达成国际性的共识。正如这篇综述所表明的,关于医院规模与预后关系的文献是具有异质的。文献中对大规模医院的定义不断变化,使得适当的荟萃分析变得困难。一些研究认为每年6或10次食管切除术的数量很高,而对于其他研究或国家来说,这则是一个低数量的医院。很少有研究寻求到最佳医院规模的临界值。然而,一项高质量的研究发现,食管切除术的数量增加达60次/年治疗结果会更好,表明这可能是一个有意义的医院规模的阈值[47]。在文献中哪些外科手术应该被纳入在医院规模的研究中甚至也存在异质性,只纳入感兴趣的手术还是更复杂的手术?外科医生手术量的作用也不明确。为了达成国际共识,文献应该被规范化。食管切除术并发症共识小组(ECCG)的一项类似的倡议将食管切除术后并发症的数据收集标准化,以促进国际性的比较研究[64]。预设规模的标准也将显著减少,研究人员调整规模的临界值以找到具有统计意义的结果的确认偏差。
总之,这篇文献综述强调了胃食管癌多学科模式治疗所有方面集中化的重要性。文献表面,从诊断到姑息治疗的胃食管癌诊疗的各个方面,都可以从大规模医院获得更好的结果。考虑到其诊疗中的的困难和争议,尤其是对于GEJ癌,高度专业的医疗人员是必要的。然而,由于关于医院规模与预后关系的文献是异质的,因此很难建立明确的国际性的医院规模的阈值。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Riccardo Rosati) for the series “Current issues on GEJ adenocarcinoma” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at: http://dx.doi.org/10.21037/aoe-2020-geja-01). The series “Current issues on GEJ adenocarcinoma” was commissioned by the editorial office without any funding or sponsorship. MIvBH serves as an unpaid editorial board member of Annals of Esophagus from May 2020 to Apr. 2022. RvH is proctoring surgeon for Intuitive Surgical Inc. and trains other surgeons in robot-assisted minimally invasive esophagectomy. MIvBH reports grants from Olympus, grants from Stryker, outside the submitted work; and MIvBH is consultant for Mylan and Medtronic and Johnson & Johnson. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018;68:394-424. [Crossref] [PubMed]
- van der Werf LR, Busweiler LAD, van Sandick JW, et al. Reporting National Outcomes After Esophagectomy and Gastrectomy According to the Esophageal Complications Consensus Group (ECCG). Ann Surg 2020;271:1095-101. [Crossref] [PubMed]
- Birkmeyer JD, Sun Y, Wong SL, et al. Hospital volume and late survival after cancer surgery. Ann Surg 2007;245:777-83. [Crossref] [PubMed]
- van Lanschot JJ, Hulscher JB, Buskens CJ, et al. Hospital volume and hospital mortality for esophagectomy. Cancer 2001;91:1574-8. [Crossref] [PubMed]
- Metzger R, Bollschweiler E, Vallböhmer D, et al. High volume centers for esophagectomy: what is the number needed to achieve low postoperative mortality? Dis Esophagus 2004;17:310-4. [Crossref] [PubMed]
- Vonlanthen R, Lodge P, Barkun JS, et al. Toward a consensus on centralization in surgery. Ann Surg 2018;268:712-24. [Crossref] [PubMed]
- Integraal Kankercentrum Nederland. Oesophaguscarcinoom. Landelijke richtlijn, versie 3.1, 2015. consulted on: 16-3-2020. Available online: https://www.oncoline.nl/oesofaguscarcinoom
- Dutch Institute for Clinical Auditing. Jaarrapport Dutch Upper gastrointestinal Cancer Audit (DUCA) 2014. consulted on: 16-3-2020. Available online: https://dica.nl/jaarrapportage-2014/duca
- Messager M, de Steur W, Boelens PG, et al. Description and analysis of clinical pathways for oesophago-gastric adenocarcinoma, in 10 European countries (the EURECCA upper gastro intestinal group - European Registration of Cancer Care). Eur J Surg Oncol 2016;42:1432-47. [Crossref] [PubMed]
- Haverkamp L, Seesing MF, Ruurda JP, et al. Worldwide trends in surgical techniques in the treatment of esophageal and gastroesophageal junction cancer. Dis Esophagus 2017;30:1-7. [PubMed]
- Gillison EW, Powell J, McConkey CC, et al. Surgical workload and outcome after resection for carcinoma of the oesophagus and cardia. Br J Surg 2002;89:344-8. [Crossref] [PubMed]
- Rodgers M, Jobe BA, O’Rourke RW, et al. Case volume as a predictor of inpatient mortality after esophagectomy. Arch Surg 2007;142:829-39. [Crossref] [PubMed]
- Nobel T, Molena D. Surgical principles for optimal treatment of esophagogastric junction adenocarcinoma. Ann Gastroenterol Surg 2019;3:390-5. [PubMed]
- Zhang S, Orita H, Fukunaga T. Current surgical treatment of esophagogastric junction adenocarcinoma. World J Gastrointest Oncol 2019;11:567. [PubMed]
- Zanoni A, Verlato G, Baiocchi GL, et al. Siewert III esophagogastric junction adenocarcinoma: does TNM 8th save us? Updates Surg 2018;70:241-9. [Crossref] [PubMed]
- Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg 1998;85:1457-9. [Crossref] [PubMed]
- Brierley JD, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours. 8th edition. John Wiley & Sons, 2017.
- van Putten M, Koëter M, van Laarhoven HW, et al. Hospital of diagnosis influences the probability of receiving curative treatment for esophageal cancer. Ann Surg 2018;267:303-10. [Crossref] [PubMed]
- Lee YC, Cook MB, Bhatia S, et al. Interobserver reliability in the endoscopic diagnosis and grading of Barrett’s esophagus: an Asian multinational study. Endoscopy 2010;42:699-704. [Crossref] [PubMed]
- van Vliet EP, Eijkemans MJ, Kuipers EJ, et al. A comparison between low-volume referring regional centers and a high-volume referral center in quality of preoperative metastasis detection in esophageal carcinoma. Am J Gastroenterol 2006;101:234-42. [Crossref] [PubMed]
- van Vliet EP, Hermans JJ, De Wever W, et al. Radiologist experience and CT examination quality determine metastasis detection in patients with esophageal or gastric cardia cancer. Eur Radiol 2008;18:2475-84. [Crossref] [PubMed]
- van Vliet EPM, Eijkemans MJ, Poley JW, et al. Staging of esophageal carcinoma in a low-volume EUS center compared with reported results from high-volume centers. Gastrointest Endosc 2006;63:938-47. [Crossref] [PubMed]
- Bachmann MO, Alderson D, Edwards D, et al. Cohort study in South and West England of the influence of specialization on the management and outcome of patients with oesophageal and gastric cancers. Br J Surg 2002;89:914-22. [Crossref] [PubMed]
- Nederlandse Vereniging van Maag-Darm-Leverartsen. Richtlijn Barrett-oesofagus. consulted on: 2-3-2020. Available online: https://www.mdl.nl/sites/www.mdl.nl/files/richlijnen/Richtlijnen%20Barrett%20oesofagus%20-%20jan%202018%20-%20tbv%20website.pdf
- Sharma P, Shaheen NJ, Katzka D, et al. AGA Clinical Practice Update on Endoscopic Treatment of Barrett’s Esophagus With Dysplasia and/or Early Cancer: Expert Review. Gastroenterology 2020;158:760-9. [Crossref] [PubMed]
- Fitzgerald RC, di Pietro M, Ragunath K, et al. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett's oesophagus. Gut 2014;63:7-42. [Crossref] [PubMed]
- van Vilsteren FG, Pouw RE, Herrero LA, et al. Learning to perform endoscopic resection of esophageal neoplasia is associated with significant complications even within a structured training program. Endoscopy 2012;44:4-12. [Crossref] [PubMed]
- Tan MC, Kanthasamy KA, Yeh AG, et al. Factors Associated With Recurrence of Barrett's Esophagus After Radiofrequency Ablation. Clin Gastroenterol Hepatol 2019;17:65-72.e5. [Crossref] [PubMed]
- Wouters MW, Gooiker GA, van Sandick JW, et al. The volume-outcome relation in the surgical treatment of esophageal cancer: a systematic review and meta-analysis. Cancer 2012;118:1754-63. [Crossref] [PubMed]
- Gruen RL, Pitt V, Green S, et al. The effect of provider case volume on cancer mortality: systematic review and meta-analysis. CA Cancer J Clin 2009;59:192-211. [Crossref] [PubMed]
- Claassen YHM, van Amelsfoort RM, Hartgrink HH, et al. Effect of hospital volume with respect to performing gastric cancer resection on recurrence and survival: results from the CRITICS trial. Ann Surg 2019;270:1096-102. [Crossref] [PubMed]
- Merkow RP, Bilimoria KY, Chow WB, et al. Variation in lymph node examination after esophagectomy for cancer in the United States. Arch Surg 2012;147:505-11. [Crossref] [PubMed]
- Dikken JL, Dassen AE, Lemmens VE, et al. Effect of hospital volume on postoperative mortality and survival after oesophageal and gastric cancer surgery in the Netherlands between 1989 and 2009. Eur J Cancer 2012;48:1004-13. [Crossref] [PubMed]
- van der Werf LR, Dikken JL, van Berge Henegouwen MI, et al. A Population-based Study on Lymph Node Retrieval in Patients with Esophageal Cancer: Results from the Dutch Upper Gastrointestinal Cancer Audit. Ann Surg Oncol 2018;25:1211-20. [Crossref] [PubMed]
- Claassen YHM, van Sandick JW, Hartgrink HH, et al. Association between hospital volume and quality of gastric cancer surgery in the CRITICS trial. Br J Surg 2018;105:728-35. [Crossref] [PubMed]
- Wouters MW, Karim-Kos HE, le Cessie S, et al. Centralization of esophageal cancer surgery: does it improve clinical outcome? Ann Surg Oncol 2009;16:1789-98. [Crossref] [PubMed]
- Javidfar J, Speicher PJ, Hartwig MG, et al. Impact of Positive Margins on Survival in Patients Undergoing Esophagogastrectomy for Esophageal Cancer. Ann Thorac Surg 2016;101:1060-7. [Crossref] [PubMed]
- van der Werf LR, Cords C, Arntz I, et al. Population-based study on risk factors for tumor-positive resection margins in patients with gastric cancer. Ann Surg Oncol 2019;26:2222-33. [Crossref] [PubMed]
- Nimptsch U, Haist T, Krautz C, et al. Hospital Volume, In-Hospital Mortality, and Failure to Rescue in Esophageal Surgery. Dtsch Arztebl Int 2018;115:793-800. [PubMed]
- Ghaferi AA, Birkmeyer JD, Dimick JB. Hospital volume and failure to rescue with high-risk surgery. Med Care 2011;49:1076-81. [Crossref] [PubMed]
- Busweiler LA, Henneman D, Dikken JL, et al. Failure-to-rescue in patients undergoing surgery for esophageal or gastric cancer. Eur J Surg Oncol 2017;43:1962-9. [Crossref] [PubMed]
- Busweiler LA, Dikken JL, Henneman D, et al. The influence of a composite hospital volume on outcomes for gastric cancer surgery: A Dutch population-based study. J Surg Oncol 2017;115:738-45. [Crossref] [PubMed]
- Coupland VH, Lagergren J, Lüchtenborg M, et al. Hospital volume, proportion resected and mortality from oesophageal and gastric cancer: a population-based study in England, 2004–2008. Gut 2013;62:961-6. [Crossref] [PubMed]
- Gordon TA, Bowman HM, Bass EB, et al. Complex gastrointestinal surgery: impact of provider experience on clinical and economic outcomes. J Am Coll Surg 1999;189:46-56. [Crossref] [PubMed]
- Milstein A, Galvin RS, Delbanco SF, et al. Improving the safety of health care: the leapfrog initiative. Eff Clin Pract 2000;3:313-6. Erratum in: Eff Clin Pract 2001 Mar-Apr;4(2):94. [PubMed]
- Christian CK, Gustafson ML, Betensky RA, et al. The Leapfrog volume criteria may fall short in identifying high-quality surgical centers. Ann Surg 2003;238:447-55; discussion 455-7. [PubMed]
- Henneman D, Dikken JL, Putter H, et al. Centralization of esophagectomy: how far should we go? Ann Surg Oncol 2014;21:4068-74. [Crossref] [PubMed]
- Kohn GP, Galanko JA, Meyers MO, et al. National trends in esophageal surgery—are outcomes as good as we believe? J Gastrointest Surg 2009;13:1900-10; discussion 1910-2.
- Patti MG, Comera CU, Glasgow RE, et al. A hospital’s annual rate of esophagectomy influences the operative mortality rate. J Gastrointest Surg 1998;2:186-92. [Crossref] [PubMed]
- Swisher SG, Deford L, Merriman KW, et al. Effect of operative volume on morbidity, mortality, and hospital use after esophagectomy for cancer. J Thorac Cardiovasc Surg 2000;119:1126-32. [Crossref] [PubMed]
- Kuo EY, Chang Y, Wright CD. Impact of hospital volume on clinical and economic outcomes for esophagectomy. Ann Thorac Surg 2001;72:1118-24. [Crossref] [PubMed]
- Kurokawa Y, Yamaguchi T, Sasako M, et al. Institutional variation in short-and long-term outcomes after surgery for gastric or esophagogastric junction adenocarcinoma: correlative study of two randomized phase III trials (JCOG9501 and JCOG9502). Gastric Cancer 2017;20:508-16. [Crossref] [PubMed]
- Kurokawa Y, Sasako M, Sano T, et al. Ten-year follow-up results of a randomized clinical trial comparing left thoracoabdominal and abdominal transhiatal approaches to total gastrectomy for adenocarcinoma of the oesophagogastric junction or gastric cardia. Br J Surg 2015;102:341-8. [Crossref] [PubMed]
- Steinert R, Gastinger I, Ridwelski K, et al. Surgical treatment of carcinomas of the oesophagogastric junction - results achieved in multicentre studies. Zentralbl Chir 2013;138:403-9. [PubMed]
- Thompson AM, Rapson T, Gilbert FJ, et al. Hospital volume does not influence long-term survival of patients undergoing surgery for oesophageal or gastric cancer. Br J Surg 2007;94:578-84. [Crossref] [PubMed]
- Miller JD, Jain MK, De Gara CJ, et al. Effect of surgical experience on results of esophagectomy for esophageal carcinoma. J Surg Oncol 1997;65:20-1. [Crossref] [PubMed]
- Sundelöf M, Lagergren J, Ye W. Surgical factors influencing outcomes in patients resected for cancer of the esophagus or gastric cardia. World J Surg 2008;32:2357-65. [Crossref] [PubMed]
- Mamidanna R, Ni Z, Anderson O, et al. Surgeon volume and Cancer Esophagectomy, gastrectomy, and pancreatectomy. Ann Surg 2016;263:727-32. [Crossref] [PubMed]
- Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010;376:687-97. [Crossref] [PubMed]
- Satoh T, Bang YJ, Gotovkin EA, et al. Quality of life in the trastuzumab for gastric cancer trial. Oncologist 2014;19:712-9. [Crossref] [PubMed]
- Dijksterhuis WPM, Verhoeven RHA, Meijer SL, et al. Increased assessment of HER2 in metastatic gastroesophageal cancer patients: a nationwide population-based cohort study. Gastric Cancer 2020; Epub ahead of print. [Crossref] [PubMed]
- Haj Mohammad N, Bernards N, van Putten M, et al. Volume-outcome relation in palliative systemic treatment of metastatic oesophagogastric cancer. Eur J Cancer 2017;78:28-36. [Crossref] [PubMed]
- Dixon M, Mahar AL, Helyer LK, et al. Prognostic factors in metastatic gastric cancer: results of a population-based, retrospective cohort study in Ontario. Gastric Cancer 2016;19:150-9. [Crossref] [PubMed]
- Low DE, Alderson D, Cecconello I, et al. International consensus on standardization of data collection for complications associated with esophagectomy. Ann Surg 2015;262:286-94. [Crossref] [PubMed]
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Voeten DM, van Hillegersberg R, van Berge Henegouwen MI, Gisbertz SS. Adenocarcinoma of the gastro-esophageal junction: is centralization policy always a good idea? Ann Esophagus 2020;3:29.



