康复训练对食管腺癌手术效果的影响
引言
对于食道癌和大多数实体肿瘤,目前建立的标准治疗包括手术和药物治疗,这两种治疗方法都被证明能显著的改善预后[1,2]。尽管提高了疗效和有了更广泛的适应证,但这两种治疗方案都会产生生理应激,并且损害短期和长期的功能,对健康造成负面影响[3-5]。食管癌的治疗过程中通常伴随着营养不良、术后并发症、身体机能下降和肌肉丢失,并可能导致情绪低落和生活质量降低[6,7]。
由于这些患者对治疗引起的并发症的易感性增加,如何强调通过术前多学科支持干预来应对生理和功能储备下降的重要性都不为过。特别是在整个疾病过程中,身体状态、营养和精神状况会影响手术效果、功能恢复、能否坚持抗肿瘤治疗和生活质量。本文将讨论决定食管手术效果的主要因素,特别强调多模式的康复训练的特点:术中管理[加速康复外科(enhanced recovery after surgery,ERAS)]和术前行为干预。
ERAS(加速康复外科)
ERAS最初设计于2000年初,旨在减少围手术期并发症和缩短住院时间[8],并迅速发展成为一种多学科、基于循证医学证据的贯穿整个围手术期的方案。目前,仅仅通过微创手术或提高麻醉技术来应对生理应激反应的复杂性是不够的。为克服疼痛、肠梗阻、活动受限、饥饿、液体过剩、血栓形成和术后分解代谢等影响恢复的多重障碍,需要联合使用多种方法。在此过程中,外科医生、麻醉师和护理人员已经不再从各自孤立的角度去思考,而应采用更广泛的综合的方法,提高护理质量、授权于患者和看护人员。
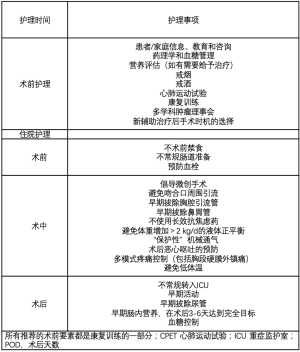
ERAS协会最近发表了改善食管切除术围手术期管理的建议[9];表1总结了其要点。它强调了外科手术注意事项(手术步骤、入路和引流)、营养优化(术前和术后)、多模式镇痛方法、早期拔管、早期渐进式活动和常规呼吸理疗的重要性[10]。一些机构已经在食管切除手术时加入了ERAS的元素,并证实在住院时间、费用和术后肺部并发症方面的改善,表明ERAS可以减轻患者和医疗系统的负担[10-12]。
Full table
尽管患者ERAS取得了显著的进步,但仍有相当比例的患者出现并发症,即使没有明显的并发症,患者完全康复可能仍需数月时间,仍需要采取更为广泛的措施。此外,除院内护理外,许多其他干预措施也可能影响手术效果[13]。身体功能的主要部分,如身体状况差、营养不良和肌肉减少及精神压力增大,是决定手术效果的关键因素[14]。考虑到这种复杂性,ERAS旨在促成一个协同的、多学科的术前护理计划,以防止与治疗相关的功能下降及其后续影响[14]。我们机构采用的预康复计划基于ERAS并与之有所叠加(见表1中的“术前护理”)。
如期所料,ERAS协会最近认可了食管切除术围手术期护理中预康复训练的作用,承认了其在手术后快速恢复到正常状态中的重要性[9]。但是,在2018年底发表的文章中,由于上消化道手术的快速康复循证证据有限,推荐等级较低。然而,自此以后ERAS逐渐发展改善。下面说明了预康复各个环节背后的证据,以对最近的研究结果进行叙述总结。
食管癌康复训练
术后康复治疗对身体机能和恢复的重要性已得到广泛认可[15,16]。然而,术前阶段是处理合并症、降低风险因素、改善机体功能和一般状态的特殊时机,如果处理不好可能会延误手术或显著影响术后康复[13,17]。营养不良在食管腺癌的整个护理过程中一直是棘手的问题。食管癌吞咽困难引起摄入不足,进而造成低蛋白和能量平衡紊乱,通常会导致营养不良。食管腺癌确诊时体重减轻(>70%)和肌肉减少(26%~75%)的发生率很高,并在整个术前阶段持续存在,并且可能在治疗过程中进一步加重[6,18]。除了一些微量元素缺乏外,贫血也较常见,并且会进一步损害患者的身体状态[19,20]。在术前阶段如营养缺乏状态不能得到改善,将对身体机能、短期和长期功能状态,以及生活质量产生不利影响[20]。
另外,对于这些患者而言,问题不仅仅是疾病带来的损伤。手术创伤的恢复必然增加能量和营养的需求[18,21]。食管腺癌治疗过程中肌肉量减少是需要考虑的一个重要因素,因其可进而增加药物毒副作用和手术并发症[6,19,22]。此外,有充分证据表明新辅助治疗(NAT)的代谢应激常会导致肌肉萎缩、身体状态和功能的下降,从而导致身体耐受性降低[5,6]。据报道,由于剂量限制性毒性的影响,在这些患者中高达70%的患者无法完成预定的围手术期治疗方案[5,6,23]。2014年,Jack等人研究了健康参数对NAT耐受性和生存相关的预测能力。通过监测无氧阈下耗氧量(VO2)[2.19 mL/(kg·min),95% CI,1.47-2.91]及峰值(2.51,95% CI,1.55-3.47)、FEV1和FVC及血红蛋白值,表明在NAT之后,患者运动耐力显著下降[5]。有氧适能水平降低也与NAT和1年生存率呈负相关。Sinclair及其同事报告了类似的结果,NAT后心肺健康状况、肺功能和血红蛋白均有下降[3]。贫血和铁缺乏在胃切除手术后将进一步加重。这些发现强调了身体健康状况在癌症治疗中的关键作用。
疾病及其相关治疗影响着患者的身心健康。因此,频繁筛查患者心理状态的重要性不言而喻。疾病相关症状、功能下降和预后不良经常导致患者在确诊后出现焦虑和抑郁的表现,而新辅助治疗的副作用往往会加剧这些表现[7]。对这些问题进行处理是重要的,因为它们可能对心理健康、自信心、临床干预的依从性、睡眠模式、疲劳感和生活质量产生不利影响[7]。高度的焦虑和抑郁也会在术后产生负面影响,如疼痛感加重、住院时间延长、恢复速度减缓[24]。
鉴于食管治疗管理的复杂性,我们倾向于评估患者机体功能状态时,不局限于传统并发症的识别,同时还要考虑决定应激顺应性的多个因素(图1)[25]。
营养
营养不良在胃肠道癌症中常见,与发病率和死亡率增加、住院时间延长、治疗效果降低和毒性增加相关[21,26-29]。它也可能因疾病进展和新辅助治疗而恶化。尽管NAT方案是大多数食管癌治疗的一个组成部分,但并非没有明显的副作用。尤其是化疗,患者在吞咽困难得到缓解同时,也会出现恶心、口腔炎、腹泻和呕吐等不良症状,导致营养状况进一步下降[19]。食管切除术也伴随着明显的并发症,术前的营养不良和功能状态低下会加剧这种状况。术后蛋白质和能量的需求均增加,而且由于对营养素的需求巨大,医源性供给通常无法满足。与其他肿瘤手术相比,即使在手术治疗后,食管切除术报告的营养不良率也是最高的,这与术后并发症密切相关。胃切除术后,可能需要长达1年的时间才能恢复到正常的营养状态[30]。
初诊时应进行系统的营养状况筛查,并需在短期内进行复查。有几种可使用的方法,例如,营养风险筛查2002(NRS 2002)和患者主观评分的整体评估表(PG-SGA)及其删减版[31,32]。检查方便的常见危险因素有低BMI(18.5 kg/m2)、非计划的体重减轻(>10%或>5%超过3个月)、低白蛋白和营养相关症状。只关注低体重和营养不良是片面的,因为肥胖在食管腺癌患者中也并不少见。此外,骨骼肌重量减少是肌肉减少症的一个主要特征,并且可以在脂肪质量变化很小的情况下发生。在最近的一项研究中,14%的食管胃癌患者存在肌少症性肥胖[33]。需要注意的是,因为肌少症性肥胖表现可能不是很明显,但与低生存率和剂量限制性NAT毒性独立相关[34,35]。由于这些原因,如果发现严重的营养风险,即使会延迟手术时间,也还是应提供至少两周的营养治疗[36],并应遵循标准化的方法[21]。在任何肿瘤治疗过程中,应向所有营养中高风险患者提供饮食咨询。如有可能,患者营养支持首选口服营养品和补充剂,并要求患者少量多餐、细嚼慢咽、优质饮食[18]。常用的加强营养支持的手段包括口服添加高蛋白质和高热量的饮料,以及液体代餐的人工营养制品[21]。鉴于疾病及其治疗带来的高代谢和分解代谢驱动,必须在整个围手术期满足高能量和高品质蛋白质需求,ESPEN指南推荐在此期间将热量摄入增加到25~30 kcal/kg/天。同样,强烈建议增加高级蛋白质的摄入量,高达1.5~2.0 g/kg/天,理想情况下,每餐至少25 g[37]。此外,还应考虑通过锻炼来对抗进一步的蛋白质分解代谢,在支持合成代谢过程同时降低肌肉减少症的风险[21,38,39]。这些目标在上消化道肿瘤中尤其具有挑战性。在饮食摄入不足的情况下,推荐肠内营养,特别是在胃肠道完整的情况下[40]。如有必要,肠内营养的途径可包括胃造口术、经皮影像引导下胃造口术或经皮内镜下空肠造口术;但选择何种方法应适合每个患者的临床状态和自身情况。
肠内营养的益处目前仍不确定,ERAS协会不推荐其作为常规使用[9]。而术前免疫增强饮食对于胃食管癌患者似乎有令人信服的理由。通过减少由癌症及其治疗引起的炎症反应和氧化应激,术前免疫增强饮食成为多模式治疗恶病质(定义为一种常规营养无法完全逆转的病症)的一个重要部分[41,42]。目前已经测试了多种营养素,例如omega-3多不饱和脂肪酸(PUFA)、精选氨基酸(精氨酸和谷氨酰胺)、核酸和多种抗氧化剂[21]。ω-3多不饱和脂肪酸具有独特的抗炎特性,之前已用于其他肿瘤人群的治疗[18]。在进展期恶性肿瘤中,它已被证明具有降低基础代谢率、降低炎症标志物和急相蛋白的潜力。此外,有人提出将改善食欲、体重管理和保护去脂体重用于某些进展期恶性肿瘤治疗[21]。
身体状况
多年来,卧床休息曾是缓解与癌症相关的身心疲劳的主要且独到的方法。庆幸的是,在过去的30年里,运动已经逐渐确立了它在减轻甚至逆转癌症及其治疗对身体健康、身体机能、癌症相关疲劳和生活质量等方面的不利影响[43]。运动的优点可能因运动类型不同而有所差别,多数运动项目的基本要素通常是有氧运动和耐力训练[44]。由于上述锻炼方法对患者的功能状态、体能和生活质量具有有益的协同作用,因此对食管癌的治疗特别有效[22]。据报道,在肿瘤治疗中,运动对疾病进展、治疗效果和安全性,以及二级预防有着重要的影响[45]。从个体角度来看,运动可以改善患者对身体状况的感知、保持心理健康和提升整体生活质量[46]。
癌症治疗会对心肺功能产生不利影响,预测会导致有氧运动能力进行性的下降,这种不利的影响即使在治疗终止后仍将持续存在,并对患者以后的心肺功能状态和生活质量产生负面影响[5]。幸运的是,有氧运动锻炼可以为患者带来许多重要的生理适应,可以减轻因治疗引起的生理上和功能上的衰退。有氧运动包括了通过各种方式进行的重复动态运动来提高心率,也可以通过多种不同的形式来实现,其形式可以是保持稳定的状态或高强度的间歇训练。目前普遍认为,在癌症患者中,有氧训练可以增加最大摄氧量、心输出量、线粒体密度、氧化电位和峰值功率输出[47]。综合的结果是可使患者获得更多的生理功能储备。
耐力训练可以减少肌萎缩并提高骨组织的适应性,改善肌肉的质量、力量和功能。已经证明,在各年龄组,耐力训练均可以改善患者的身体构成、体重和身体素质,对于身体虚弱的人群和老年患者则更为重要。通过耐力训练也可达到同样的效果[13,39,48]。耐力训练适用于以下人群,新辅助治疗(NAT)患者报告去脂体重平均减少约5 kg、且握力均减少约4 kg[49],此项表明存在迅速加重的肌少性肥胖,是术后并发症风险和长期预后不良的独立预测因子[50]。
社会心理状况
对于患者而言,任何重大的择期手术的术前阶段都伴随着高度的苦恼、焦虑和抑郁[7]。对于食管腺癌患者,还常混杂着疾病的不良预后和令人恐惧的生理上的表现,并导致治疗依从性差、术后治疗效果不佳[51]。研究表明,除了对疼痛敏感度增加、身体机能和生活质量降低之外,心理困扰状态还会降低循环免疫调节因子、改变伤口愈合的生理机制、增加住院时间、增加医疗成本[17,52,53]。
因此,人们已经清楚地认识到,康复训练计划不仅不能仅聚焦于改善身体健康,还应通过心理干预措施,关注患者的社会心理健康,降低焦虑、抑郁的发生率,还应提高患者的参与度和自主性[53]。尽管目前对于何种干预是最佳心理预康复措施尚无共识,但大多数干预措施通常包括与心理学家或有资质的医疗保健专业人员进行单独会面,他们通常会使用影像引导放松方法和减压技巧,同时会提供解决和应对问题的策略[51,53]。
证据状况
术前营养
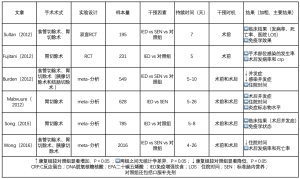
表2总结了食管胃手术前进行营养治疗的现有证据和争议。由Burden等人进行的Cochrane Meta分析表明,胃肠手术前提供肠外营养可显著减少术后并发症,但未发现标准口服补充剂与给予肠内营养间有明显差异[54]。该研究的关注点也集中在免疫营养和肠道补充精氨酸,omega-3脂肪酸和核糖核苷酸。在同一Meta分析中,有7项试验侧重于免疫营养,都显示出免疫营养对改善术后并发症有显著效果(RR 0.67,95% CI,0.53~0.84)[54]。2016年,Wong等人发表了一项Meta分析,包括2 016例接受食管切除术、胃切除术和胰腺切除术的患者;与标准肠内营养相比,免疫营养降低了感染风险,缩短了住院时间。但是,从其他的研究中可以得出完全不同的结论,这些研究没有显示免疫增强饮食的任何临床益处[55]。Fujitani等人发现,在营养良好并接受选择性胃切除术的患者中,感染并发症的发生率和总发病率没有差异[56];Sultan等人也报告了类似的结果,他们对食管胃手术患者补充了omega-3多不饱和脂肪酸[57]。两项Meta分析均报告对术后并发症和住院时间没有影响,包括785名接受胃部手术的患者[58]和628名接受食管胃手术的患者[59]。鉴于这些尚未解决的问题,ERAS协会不支持常规应用免疫营养。
Full table
体能训练
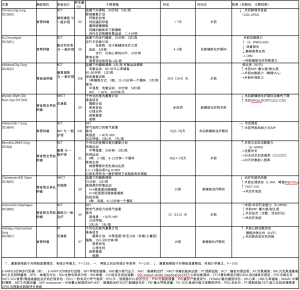
表3总结了近期在探索食管胃手术前进行体能训练效果的前瞻性试验。不同研究之间训练项目的差异很大,特别是在运动形式、监督、持续时间和结果测量等方面。吸气肌训练(IMT)是研究最多的干预措施之一,此项训练被认为是一种旨在提高呼吸肌力量和耐力的呼吸锻炼方法。尽管有数据表明术前IMT可以改善肺功能,但对接受食管切除术的患者术后肺部并发症的影响尚不清楚。Inoue等人对100名食管癌患者进行了回顾性分析,表明术前多模式肺康复与肺部并发症风险显著降低相关(OR 0.14,95% CI,0.02~0.064)[68]。相反,其他前瞻性研究并未显示对术后的结果有任何显著改变,如功能性行走能力和肺部并发症[60,66,69]。在其中一项试验中,Valkenet等人证明与标准护理相比,基于家庭的高强度IMT计划并没有减少术后肺炎的发生[69]。有几个因素可以解释这些结果,例如干预因素的持续时间、过程无人监督和对方案的依从性相对较低(只54%的患者完成了规定的训练计划的80%以上,并且只有40%计划以规定的强度完成)。尽管如此,鉴于IMT对术前肺功能的积极影响,这样的负面结果还是出乎意料[66,69]。
Full table
Christensen等最近研究了康复锻炼在改善治疗耐受性中的潜在作用,并证明在新辅助治疗期间有监督的锻炼降低了不能按计划实施手术的风险[65]。妨碍手术切除的严重不良事件,如疾病进展或身体状况恶化,在运动组中发生率为5%,而在对照组中为21%(RR 0.23,95% CI,0.04~1.29)。该研究的主要不足在于样本量相对较小和非随机对照设计。该研究还发现干预组在功能状态(FACT-E平均评分:9.6,95% CI,1.0~18.1)、峰值功率输出(12 W,95% CI,0.1~24.0)和VO2峰值[1.39 mL/(kg·min),95% CI,0.03~2.74]方面有着显著的提高。有趣的是,尽管在整个术前阶段观察到患者体重持续下降,但是运动组的体重或去脂体重并未发生明显变化。
Barberan-Garcia等人进行了一项随机对照试验(RCT),实验对象为125名拟行腹部大手术的患者,其目的是研究康复锻炼对术后并发症的影响WR[70]。实验组在监督下进行锻炼课程,每周1~3次,包括在循环测力计上的高强度间歇训练,其强度在患者基线最大工作速率的40%和70%~85%之间交替。与对照组相比,研究组术前有氧运动能力有了明显的改善(耐力时间135%;P<0.001),而且术后并发症发生率明显降低51%(RR 0.5;95% CI,0.3~0.8,P=0.001)。遗憾的是,只有18名参与者(康复组10名,对照组8名)接受了胃食管手术,正因如此,数量这么少的证据说服力不足。Halliday等人最近的一项单组、单中心的前瞻性研究显示了在多种模式相结合的预康复锻炼背景下进度和运动量的重要性[67]。该研究证明术前大运动量的锻炼,除了对术前身体状况有积极影响外,还可以减少食管切除术的肺部并发症。
社会心理干预
虽然术前应激管理已被证明可以减少许多肿瘤人群的焦虑和抑郁情绪,但很少有研究涉及其对食管癌患者的影响[51]。Zhang等人进行的一项研究调查了围手术期心理支持对食管癌患者的影响[71]。该研究采用了多学科的三阶段方法,包括术前和术后干预,旨在改善新入院的拟手术患者的心理健康和手术预后[72]。研究报告,整个围手术期的心理支持可显著改善这些患者术后多变量的身心状态及住院时间[20.06(3.73) vs 23.24(7.37);P=0.041]。Scarpa等人的一项类似研究调查了心理支持和睡眠管理对HRQL(健康相关生活质量)和自我报告的睡眠质量的影响。作者发现,常见于常规护理组的HRQL(OR:0.23;95% CI,0.06~0.61)和睡眠质量(OR:0.27;95% CI,0.1~0.73)下降,在实验组中下降的幅度较小[72]。
多模式策略
2002年,Persson等人在胃肠道肿瘤患者中测试了一种多模式方法。他们使用2×2随机对照试验设计,研究了营养、生理和心理支持对身体状况和生存的影响[73]。多模式干预在12个月和24个月时对体重增加有轻微益处,并且没有发现其他差别。然而,这项研究有几个不足:首先,只有32名胃癌患者,很明显,样本量很小;其次,患者对营养计划的依从性非常低(只有一半的人群达到了推荐能量摄入量的75%),而且未行手术。我们的研究组进行的一项随机对照试验研究了多模式康复对拟行胃癌手术患者围手术期功能变化的影响。在随机对照试验中,51名患者被招募并随机分为对照组或预康复组;后者除了由有资质的医疗保健专业人员提供家庭运动计划外,还包括个性化的饮食计划。对高危患者提供心理干预,并将其纳入护理标准。所有患者在基线、术前和术后4~8周完成了多学科评估。研究表明,与对照组相比,相对于基线功能而言,预康复训练使术前基线功能[6分钟步行距离的变化36.9(51.4)与22.8(52.5)m,P<0.001]和术后基线功能[15.4(65.6)与81.8(87.0)m,P<0.001]显著改善。但手术和术后并发症无显著变化[4]。与我们的研究相似,Wynter-Blyth及其同事开展了一项观察性研究,调查多模式预康复计划PREPARE对拟行新辅助化疗和手术的胃食管肿瘤患者的影响。尽管患者的功能并没有如之前的研究中观察到的有所改善,但是功能和生活质量也没有出现明显的变化,表明采取干预措施可以防止常规护理中经常见到的功能状态的下降[63]。
知识缺口和未来方向
鉴于在研究人群和干预方案中都存在大量的异质性,因此从文献中很难得出定论。异质性可以反映在癌症的不同解剖位置(胃和食管),以及不同的临床阶段、病理类型(腺癌或鳞状细胞癌)、新辅助治疗(NACT或NACRT)和手术干预(胃切除或食管切除,开放或微创)等方面。需要强调的各种干预措施之间存在显著差异的方面还有锻炼频率、持续时间、强度、数量和受监督的程度。
与食管癌相关的康复科学正在迅速发展,就其本身而言,很多方面仍不明了且需要进一步研究。通过检测心肺状态得出的功能已被认为是患者对新辅助治疗耐受性的重要预测参数,同时也是生存率的重要预测参数[5]。为此,O'Neil等人的系统回顾证实,术前健康状况较差往往与术后肺部并发症风险增加有关[74]。在新辅助治疗期间进行锻炼被认为是安全可行的,并且可提供重要的生理适应。锻炼可以改善健康状态,因此被认为是食管癌康复的基本措施[65]。尽管美国运动医学会已经发布了针对癌症患者的运动指南,但目前对有效对抗新辅助治疗和手术不利影响的最佳的运动方案尚无共识。需要进一步研究的其他相关方面包括有氧运动的不同强度(高强度间歇训练 vs 中等稳定状态)、锻炼场所(家庭干预 vs 监督干预)和呼吸肌训练方案。
营养状态不良和不明原因的体重减轻是上消化道肿瘤的常见特点,并且使得患者术后并发症发生率和死亡率增加[39,48]。因此,早期营养支持的重要性不言而喻。有一点需要特别注意,那就是要采取措施以确保患者有足够的营养并要防止生理储备的过度消耗[39]。服用膳食补充剂可能是食管癌营养管理的一种行之有效的办法。同样,据报道补充免疫调节营养素、蛋白质和强化剂可改善患者营养状况和术后并发症[19,41]。然而,由于文献的异质性,需要高质量的研究来决定理想的营养组合和剂量,以显著降低术后并发症发生率和死亡率。
众所周知,癌症的诊断和治疗都与抑郁和焦虑等情绪有关,而这些情绪会对术后疼痛和康复产生负面影响。然而,很少有研究评估在手术前为这些患者提供心理支持所带来的潜在收益,以及它对术后并发症和生活质量的影响。
即使是试图整合上述所有组成部分的多模式预康复锻炼方案,其在食管癌治疗方面的证据依然不足,因为该方案通常基于回顾性研究,缺乏统计学信服力,并且大多关注短期结果。尽管如此,目前的数据仍表明,预康复锻炼方案为高危患者带来了希望。此外,特别是对于食管腺癌,我们相信需要进行大样本量的有说服力的纵向研究,以恰当的评估其对术后并发症和长期预后的影响。
结论
尽管许多临床医生都认同要在癌症治疗过程中想尽办法维持患者的身体、营养和心理状态,但对于食管癌切除复杂的围手术期风险管理方面的数据仍然不足。
防止围手术期心肺储备功能下降是最重要的。虽然还需要进一步的研究才能得出对手术和长期预后影响的结论,但越来越多的证据表明了预康复对改善围手术期功能方面的有效性和安全性。遵循加速康复路径的理念,我们建议在临床治疗中引入预康复训练,使其作为实施多学科模式和循证干预的一种手段,以期在这些具有挑战性的患者的治疗中实现更高标准的医疗服务。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Riccardo Rosati) for the series “Current issues on GEJ adenocarcinoma” published in Annals of Esophagus. The article has undergone external peer review.
Conflict of interest: All authors have completed the ICMJE uniform disclosure form (available at: http://dx.doi.org/10.21037/aoe-2020-15. The series “Current issues on GEJ adenocarcinoma” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011;29:1715-21. [Crossref] [PubMed]
- Ferri LE, Ades S, Alcindor T, et al. Perioperative docetaxel, cisplatin, and 5-fluorouracil (DCF) for locally advanced esophageal and gastric adenocarcinoma: a multicenter phase II trial. Ann Oncol 2012;23:1512-7. [Crossref] [PubMed]
- Sinclair R, Navidi M, Griffin S, et al. The impact of neoadjuvant chemotherapy on cardiopulmonary physical fitness in gastro-oesophageal adenocarcinoma. Ann R Coll Surg Engl 2016;98:396-400. [Crossref] [PubMed]
- Minnella EM, Awasthi R, Loiselle SE, et al. Effect of Exercise and Nutrition Prehabilitation on Functional Capacity in Esophagogastric Cancer Surgery: A Randomized Clinical Trial. JAMA Surg 2018;153:1081-9. [Crossref] [PubMed]
- Jack S, West MA, Raw D, et al. The effect of neoadjuvant chemotherapy on physical fitness and survival in patients undergoing oesophagogastric cancer surgery. Eur J Surg Oncol 2014;40:1313-20. [Crossref] [PubMed]
- Elliott JA, Doyle SL, Murphy CF, et al. Sarcopenia: Prevalence, and Impact on Operative and Oncologic Outcomes in the Multimodal Management of Locally Advanced Esophageal Cancer. Ann Surg 2017;266:822-30. [Crossref] [PubMed]
- Pinto E, Cavallin F, Scarpa M. Psychological support of esophageal cancer patient? J Thorac Dis 2019;11:S654-62. [Crossref] [PubMed]
- Kehlet H, Mogensen T. Hospital stay of 2 days after open sigmoidectomy with a multimodal rehabilitation programme. Br J Surg 1999;86:227-30. [Crossref] [PubMed]
- Low DE, Allum W, De Manzoni G, et al. Guidelines for Perioperative Care in Esophagectomy: Enhanced Recovery After Surgery (ERAS((R))) Society Recommendations. World J Surg 2019;43:299-330. [Crossref] [PubMed]
- Lee L, Li C, Robert N, et al. Economic impact of an enhanced recovery pathway for oesophagectomy. Br J Surg 2013;100:1326-34. [Crossref] [PubMed]
- Markar SR, Karthikesalingam A, Low DE. Enhanced recovery pathways lead to an improvement in postoperative outcomes following esophagectomy: systematic review and pooled analysis Esophagectomy enhanced recovery pathway. Dis Esophagus 2015;28:468-75. [Crossref] [PubMed]
- Chao L, Sudarshan M, Lorenzo F. Enhanced Recovery Programs for Upper Gastrointestinal Surgery: How I Do It. In: The SAGES / ERAS® Society Manual of Enhanced Recovery Programs for Gastrointestinal Surgery. 2015:313-27.
- Carli F, Zavorsky GS. Optimizing functional exercise capacity in the elderly surgical population. Curr Opin Clin Nutr Metab Care 2005;8:23-32. [Crossref] [PubMed]
- Minnella EM, Carli F. Prehabilitation and functional recovery for colorectal cancer patients. Eur J Surg Oncol 2018;44:919-26. [Crossref] [PubMed]
- O’Neill L, Guinan E, Doyle SL, et al. Rehabilitation strategies following esophageal cancer (the ReStOre trial): a feasibility study. Dis Esophagus 2017;30:1-8. [Crossref]
- Chasen MR, Bhargava R. A rehabilitation program for patients with gastroesophageal cancer—a pilot study. Support Care Cancer 2010;18:S35-40. [Crossref] [PubMed]
- Le Roy B, Selvy M, Slim K. The concept of prehabilitation: What the surgeon needs to know? J Visc Surg 2016;153:109-12. [Crossref] [PubMed]
- Jordan T, Mastnak DM, Palamar N, et al. Nutritional Therapy for Patients with Esophageal Cancer. Nutr Cancer 2018;70:23-9. [Crossref] [PubMed]
- Steenhagen E, van Vulpen JK, van Hillegersberg R, et al. Nutrition in peri-operative esophageal cancer management. Expert Rev Gastroenterol Hepatol 2017;11:663-72. [Crossref] [PubMed]
- Lagergren J, Smyth E, Cunningham D, et al. Oesophageal cancer. Lancet 2017;390:2383-96. [Crossref] [PubMed]
- Arends J, Bachmann P, Baracos V, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr 2017;36:11-48. [Crossref] [PubMed]
- Doganay E, Moorthy K. Prehabilitation for esophagectomy. J Thorac Dis 2019;11:S632-8. [Crossref] [PubMed]
- Le Roy B, Pereira B, Bouteloup C, et al. Effect of prehabilitation in gastro-oesophageal adenocarcinoma: study protocol of a multicentric, randomised, control trial—the PREHAB study. BMJ Open 2016;6:e012876. [Crossref] [PubMed]
- Mavros MN, Athanasiou S, Gkegkes ID, et al. Do Psychological Variables Affect Early Surgical Recovery? PLoS One 2011;6:e20306. [Crossref] [PubMed]
- Minnella EM, Gillis C, Edgar L, et al. Prehabilitation. In: Ljungqvist O, Francis NK, Urman RD, editors. Enhanced Recovery After Surgery - A Complete Guide to Optimizing Outcomes. Springer Nature, 2020:89-99.
- Bozzetti F. Screening the nutritional status in oncology: a preliminary report on 1,000 outpatients. Support Care Cancer 2009;17:279-84. [Crossref] [PubMed]
- Ejaz A, Spolverato G, Kim Y, et al. Impact of body mass index on perioperative outcomes and survival after resection for gastric cancer. J Surg Res 2015;195:74-82. [Crossref] [PubMed]
- Rey-Ferro M, Castano R, Orozco O, et al. Nutritional and immunologic evaluation of patients with gastric cancer before and after surgery. Nutrition 1997;13:878-81. [Crossref] [PubMed]
- Malone DL, Genuit T, Tracy JK, et al. Surgical site infections: reanalysis of risk factors. J Surg Res 2002;103:89-95. [Crossref] [PubMed]
- Ryu SW, Kim IH. Comparison of different nutritional assessments in detecting malnutrition among gastric cancer patients. World J Gastroenterol 2010;16:3310-7. [Crossref] [PubMed]
- Kondrup J, Rasmussen HH, Hamberg O, et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003;22:321-36. [Crossref] [PubMed]
- Gabrielson DK, Scaffidi D, Leung E, et al. Use of an abridged scored Patient-Generated Subjective Global Assessment (abPG-SGA) as a nutritional screening tool for cancer patients in an outpatient setting. Nutr Cancer 2013;65:234-9. [Crossref] [PubMed]
- Anandavadivelan P, Brismar TB, Nilsson M, et al. Sarcopenic obesity: A probable risk factor for dose limiting toxicity during neo-adjuvant chemotherapy in oesophageal cancer patients. Clin Nutr 2016;35:724-30. [Crossref] [PubMed]
- Palmela C, Velho S, Agostinho L, et al. Body Composition as a Prognostic Factor of Neoadjuvant Chemotherapy Toxicity and Outcome in Patients with Locally Advanced Gastric Cancer. J Gastric Cancer 2017;17:74-87. [Crossref] [PubMed]
- Tan BH, Brammer K, Randhawa N, et al. Sarcopenia is associated with toxicity in patients undergoing neo-adjuvant chemotherapy for oesophago-gastric cancer. Eur J Surg Oncol 2015;41:333-8. [Crossref] [PubMed]
- Weimann A, Braga M, Harsanyi L, et al. ESPEN Guidelines on Enteral Nutrition: Surgery including organ transplantation. Clin Nutr 2006;25:224-44. [Crossref] [PubMed]
- McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2016;40:159-211. [Crossref] [PubMed]
- Licker M, Navarro R. Prehabilitation in Thoracic Surgery. Anesthesia in Thoracic Surgery. Springer, 2020:33-47.
- Anandavadivelan P, Lagergren P. Cachexia in patients with oesophageal cancer. Nat Rev Clin Oncol 2016;13:185-98. [Crossref] [PubMed]
- Bozzetti F, Arends J, Lundholm K, et al. ESPEN Guidelines on Parenteral Nutrition: non-surgical oncology. Clin Nutr 2009;28:445-54. [Crossref] [PubMed]
- Mimatsu K, Fukino N, Ogasawara Y, et al. Effects of Enteral Immunonutrition in Esophageal Cancer. Gastrointestinal tumors 2018;4:61-71. [Crossref] [PubMed]
- Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011;12:489-95. [Crossref] [PubMed]
- Campbell KL, Winters-Stone KM, Wiskemann J, et al. Exercise Guidelines for Cancer Survivors: Consensus Statement from International Multidisciplinary Roundtable. Med Sci Sports Exerc 2019;51:2375-90. [Crossref] [PubMed]
- American College of Sports M, Riebe D, Ehrman JK, et al. ACSM's guidelines for exercise testing and prescription. Tenth edition. Philadelphia: Wolters Kluwer, 2018.
- Christensen JF, Simonsen C, Hojman P. Exercise Training in Cancer Control and Treatment. Compr Physiol 2018;9:165-205. [Crossref] [PubMed]
- Fuller JT, Hartland MC, Maloney LT, et al. Therapeutic effects of aerobic and resistance exercises for cancer survivors: a systematic review of meta-analyses of clinical trials. Br J Sports Med 2018;52:1311. [Crossref] [PubMed]
- Scott JM, Zabor EC, Schwitzer E, et al. Efficacy of Exercise Therapy on Cardiorespiratory Fitness in Patients With Cancer: A Systematic Review and Meta-Analysis. J Clin Oncol 2018;36:2297-305. [Crossref] [PubMed]
- Mislang AR, Di Donato S, Hubbard J, et al. Nutritional management of older adults with gastrointestinal cancers: An International Society of Geriatric Oncology (SIOG) review paper. Journal of geriatric oncology 2018;9:382-92. [Crossref] [PubMed]
- Guinan EM, Doyle SL, Bennett AE, et al. Sarcopenia during neoadjuvant therapy for oesophageal cancer: characterising the impact on muscle strength and physical performance. Support Care Cancer 2018;26:1569-76. [PubMed]
- Simonsen C, de Heer P, Bjerre ED, et al. Sarcopenia and Postoperative Complication Risk in Gastrointestinal Surgical Oncology: A Meta-analysis. Ann Surg 2018;268:58-69. [Crossref] [PubMed]
- Scheede-Bergdahl C, Minnella EM, Carli F. Multi-modal prehabilitation: addressing the why, when, what, how, who and where next? Anaesthesia 2019;74 Suppl 1:20-6. [Crossref] [PubMed]
- Walburn J, Vedhara K, Hankins M, et al. Psychological stress and wound healing in humans: A systematic review and meta-analysis. Journal of Psychosomatic Research 2009;67:253-71. [Crossref] [PubMed]
- Tsimopoulou I, Pasquali S, Howard R, et al. Psychological Prehabilitation Before Cancer Surgery: A Systematic Review. Ann Surg Oncol 2015;22:4117-23. [Crossref] [PubMed]
- Burden S, Todd C, Hill J, et al. Pre-operative nutrition support in patients undergoing gastrointestinal surgery. Cochrane Database Syst Rev 2012;11:CD008879. [Crossref] [PubMed]
- Wong CS, Aly EH. The effects of enteral immunonutrition in upper gastrointestinal surgery: A systematic review and meta-analysis. Int J Surg 2016;29:137-50. [Crossref] [PubMed]
- Fujitani K, Tsujinaka T, Fujita J, et al. Prospective randomized trial of preoperative enteral immunonutrition followed by elective total gastrectomy for gastric cancer. Br J Surg 2012;99:621-9. [Crossref] [PubMed]
- Sultan J, Griffin SM, Di Franco F, et al. Randomized clinical trial of omega-3 fatty acid-supplemented enteral nutrition versus standard enteral nutrition in patients undergoing oesophagogastric cancer surgery. Br J Surg 2012;99:346-55. [Crossref] [PubMed]
- Song GM, Tian X, Liang H, et al. Role of Enteral Immunonutrition in Patients Undergoing Surgery for Gastric Cancer: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Medicine (Baltimore) 2015;94:e1311. [Crossref] [PubMed]
- Mabvuure NT, Roman I, Khan OA. Enteral immunonutrition versus standard enteral nutrition for patients undergoing oesophagogastric resection for cancer. Int J Surg 2013;11:122-7. [Crossref] [PubMed]
- Yamana I, Takeno S, Hashimoto T, et al. Randomized Controlled Study to Evaluate the Efficacy of a Preoperative Respiratory Rehabilitation Program to Prevent Postoperative Pulmonary Complications after Esophagectomy. Dig Surg 2015;32:331-7. [Crossref] [PubMed]
- Xu YJ, Cheng JC, Lee JM, et al. A Walk-and-Eat Intervention Improves Outcomes for Patients With Esophageal Cancer Undergoing Neoadjuvant Chemoradiotherapy. Oncologist 2015;20:1216-22. [Crossref] [PubMed]
- Valkenet K, Trappenburg JC, Schippers CC, et al. Feasibility of Exercise Training in Cancer Patients Scheduled for Elective Gastrointestinal Surgery. Dig Surg 2016;33:439-47. [Crossref] [PubMed]
- Wynter-Blyth V, Halliday L, Osborn H, et al. Prehabilitation reduces the extent of functional deterioration associated with neoadjuvant chemotherapy (NAC) and surgery in patients with oesophago-gastric cancer. Clin Nutr Exp 2017;19:86.
- Valkenet K, Trappenburg JCA, Ruurda JP, et al. Multicentre randomized clinical trial of inspiratory muscle training versus usual care before surgery for oesophageal cancer. Br J Surg 2018;105:502-11. [Crossref] [PubMed]
- Christensen JF, Simonsen C, Banck-Petersen A, et al. Safety and feasibility of preoperative exercise training during neoadjuvant treatment before surgery for adenocarcinoma of the gastro-oesophageal junction. BJS Open 2018;3:74-84. [Crossref] [PubMed]
- Guinan EM, Forde C, O’Neill L, et al. Effect of preoperative inspiratory muscle training on physical functioning following esophagectomy. Dis Esophagus 2019;32:doy091. [Crossref] [PubMed]
- Halliday LJ, Doganay E, Wynter-Blyth V, et al. Adherence to Pre-operative Exercise and the Response to Prehabilitation in Oesophageal Cancer Patients. J Gastrointest Surg 2020. Epub ahead of print. [Crossref] [PubMed]
- Inoue J, Ono R, Makiura D, et al. Prevention of postoperative pulmonary complications through intensive preoperative respiratory rehabilitation in patients with esophageal cancer Prevention of pulmonary complications. Dis Esophagus 2013;26:68-74. [Crossref] [PubMed]
- Valkenet K, Trappenburg JCA, Ruurda JP, et al. Multicentre randomized clinical trial of inspiratory muscle training versus usual care before surgery for oesophageal cancer. Br J Surg 2018;105:502-11. [Crossref] [PubMed]
- Barberan-Garcia A, Ubré M, Roca J, et al. Personalised Prehabilitation in High-risk Patients Undergoing Elective Major Abdominal Surgery: A Randomized Blinded Controlled Trial. Ann Surg 2018;267:50-6. [Crossref] [PubMed]
- Zhang XD, Zhao QY, Fang Y, et al. Perioperative comprehensive supportive care interventions for Chinese patients with esophageal carcinoma: a prospective study. Asian Pac J Cancer Prev 2013;14:7359-66. [Crossref] [PubMed]
- Scarpa M, Pinto E, Saraceni E, et al. Randomized clinical trial of psychological support and sleep adjuvant measures for postoperative sleep disturbance in patients undergoing oesophagectomy. Br J Surg 2017;104:1307-14. [Crossref] [PubMed]
- Persson CR, Johansson BB, Sjoden PO, et al. A randomized study of nutritional support in patients with colorectal and gastric cancer. Nutr Cancer 2002;42:48-58. [Crossref] [PubMed]
- O’Neill L, Moran J, Guinan EM, et al. Physical decline and its implications in the management of oesophageal and gastric cancer: a systematic review. J Cancer Surviv 2018;12:601-18. [Crossref] [PubMed]

崔永
1997年硕士研究生毕业后在卫生部山东医科大学第二附属医院胸外科工作,1999年晋升主治医师。2002年考入首都医科大学攻读胸外科博士学位。博士毕业后留北京友谊医院胸外科工作,2008年获得副主任医师专业技术资格,2009年被评为硕士导师,2010年聘为副主任医师,2011年晋升副教授。2012年以访问学者身份赴美国DUKE大学胸外科学习。2015被选拔为北京市卫生系统高层次卫生技术人才。2016年晋升主任医师。自毕业以来,一直从事胸外科临床、教学和科研工作。工作重点为肺癌、食管癌的发生、发展的机理研究和早期诊断及综合治疗。长期担负胸外科的授课、见习和实习的教学任务,并协助完成科室研究生的培养工作。近年来在SCI和统计源期刊以第一作者或通讯作者发表论文30余篇。(更新时间:2021/9/28)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Minnella EM, Drummond K, Carli F. The impact of prehabilitation on surgical outcomes. Ann Esophagus 2021;4:10.