开放、杂交或者全腔镜微创食管切除术:基于系统性文献检索的全面综述
前言
与其他类型外科手术相比,食管切除术的术后并发症发生率更高。因此,无论是对于患者的短期术后疗效还是远期生活质量(long-term health-related quality of life, HRQOL),建立最合适的手术方式都至关重要。
1992年,来自苏格兰邓迪市的Alfred Cuschieri首次报道了5例胸腔镜辅助食管切除术的成功实施:俯卧位完成胸腔镜操作,然后采用类似McKeown所描述的开放式手术的三步法行剖腹探查[1]。从那时起,各种微创食管切除术(MIE)逐渐出现:从开放式联合部分微创的杂交手术到完全微创完成的手术方式,在过去几十年里逐渐被报道。胸腔镜手术中各种不同的体位(俯卧位、半俯卧位、左侧卧位),以及不同的手术方式(两步法、三步法)逐渐出现。除此之外,机器人辅助MIE(robot-assisted MIE,RAMIE)在近几年里也越来越流行。
本文通过对已发表的科学文献进行全面、系统的检索和总结,讨论了三种目前最主要的手术方式:开放式食管切除术(OE)、全微创食管切除术(TMIE)和杂交微创食管切除术(HMIE),也包括机器人辅助手术。
文献检索
本文对PubMed、Web of Science、Embase和Cochrane数据库进行了相关研究的文献检索。检索词定义为:“食管切除术”“微创手术”“腹腔镜手术”“微创”“微创外科”及“杂交”。纳入标准为:(Ⅰ)发表语言为英语的研究;(Ⅱ)对比开放式手术和微创手术或杂交手术的随机对照研究(RCTs)或队列研究(前瞻性和回顾性),不包括单纯的个案报道。对于相同或相似的重复研究则纳入其最新发表的研究。
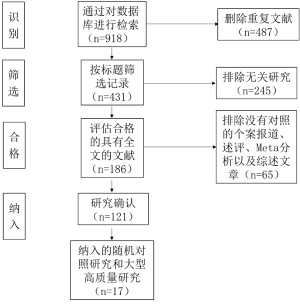
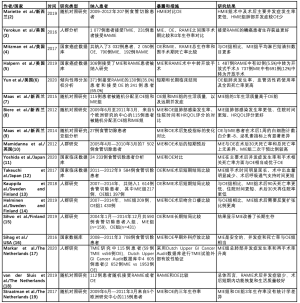
第一步,检索共获得918篇文献,通过对文献标题、摘要及部分文章的全文阅读,筛选出186项研究。第二步,排除述评、个案报道、Meta分析以及综述文章,获得了121篇文献(图1)。第三步,随机对照研究和大型队列研究被最终纳入本文。对于在检索完成之后发表的研究,在写作本文过程中也将其纳入。纳入标准的细节在表1展示。
Full table
开放式手术和微创手术的总体情况
开放式手术多年来一直是食管癌治疗的金标准,迄今为止仍是可靠且有效的治疗手段。但是,开放式手术的缺点在于需要巨大的手术切口,包括中上腹开腹探查及撑开肋骨的开胸探查,给患者带来了不可逆的手术创伤。微创食管切除术在腔镜系统的辅助下,具有一些优势(至少从理论上),包括手术切口更小、手术视野放大及视觉分辨率的提高,但是给患者带来的相关获益(临床上)仍尚不明确。
下文提到的研究比较了开放式手术和杂交手术及全腔镜微创手术的结果,结果较为复杂。一项英国的人群研究数据显示,开放式手术和杂交微创手术在疾病术后复发率和术后30天死亡率上没有差异,但微创手术组患者二次干预的比例较高,可能在一定程度上受到微创食管切除术学习曲线的影响。日本的一项全国性研究比较了开放式手术和杂交微创手术的结果,显示微创手术后短期效果更好,尤其是呼吸道并发症更少,而且术中失血量更少;但手术时间更长、二次手术比例更高,术后死亡率没有差异。在另一项包括24,233例接受食管切除术的日本人群队列研究中,证实MIE技术在术后并发症发生率和死亡率方面优于或不劣于OE[11]。美国一项基于国家癌症数据库的研究表明,MIE技术清扫的淋巴结数量明显高于OE,住院时间也比OE短;而切缘阴性、二次入院、术后30天死亡率和3年生存率上两组相似,研究结论是食管癌的微创手术可以改善患者围手术期的预后,但不影响患者最终的生存率[3]。最近另一项使用上述数据库的研究也证实,MIE可以达到与开放式手术同等的肿瘤预后和生存率[4](表1)。
开放式手术(OE)和全微创食管切除术(TMIE)的比较
全微创食管切除术有多种术式,一种是Ivor Lewis全微创食管切除术,由于该术式需要在胸腔镜下进行食管—胃胸腔内吻合,对外科医生的技术是一个挑战。该术式首先在患者仰卧位时,进行腹腔镜下管胃制作和腹腔淋巴结清扫,然后患者需要重新摆放体位(俯卧位、伴俯卧位或者左侧卧位),进行胸腔镜下右侧胸腔的手术操作。另一种全微创食管切除术甚至更加微创:经腹腔镜微创食管切除术。该术式模拟开腹食管切除术,腹腔镜下进行胃和胃食管交界处的游离,以及经食管裂孔行下段食管的游离,然后行中上腹小切口和传统的左侧颈部切口。上纵隔食管的游离通常采用顿性分离及所谓的“拔脱术”,与开放式食管切除术的“拔脱术”方法类似。最后一种方法是McKeown三步法全微创食管切除术,也是第一个被广泛运用的MIE技术。McKeown法首先在患者俯卧位、半俯卧位或者左侧卧位时,胸腔镜游离食管及纵隔淋巴结清扫;然后仰卧位完成腹腔镜下胃的游离及腹腔淋巴结清扫;最后进行颈部切口,将管胃牵拉至颈部完成颈部吻合[20]。
全微创食管切除术适用于所有患者,与年龄、肿瘤大小,以及患者身体状况一般关系较小。欧洲的一项多中心全微创食管切除术随机对照(RCT)研究,虽然样本量较少,但首次对比了开放式手术和全微创手术的区别。该研究显示全微创食管切除术组术后发生肺部感染的概率更低,住院时间更短,淋巴结清扫个数及R0切除率两组相当。对所有患者进行了术后6周的健康相关生命质量(HRQOL)随访显示,除外精神心理因素,全微创食管切除组比开放式手术组更好[8]。随后发表的数据显示该研究对全微创食管切除组进行了术后每年的健康相关生命质量随访[7],结果显示两组之间的3年无疾病生存率无统计学差异。本研究的一项亚组分析研究了开放式和全微创术后患者的免疫功能改变,发现术后1周微创食管切除术组患者的白细胞计数、IL-8和泌乳素水平更低,提示微创组炎症反应更轻、对免疫系统影响可能更小。
近期的一项瑞典和芬兰的人群研究,比较了全微创食管切除术中的Ivor Lewis和McKeown两种术式与开放式手术的术后短期随访结果,显示微创组在术后90天死亡率、住院时间,以及术后30天内再住院率均低于开放式手术组。另一项来自同一组的瑞典-芬兰人群研究报道显示,全微创组术后吻合口狭窄率比开放式手术高,往往需要术后反复扩张治疗。
在一项基于美国胸外科医师协会国家数据库的对照研究中,比较了从2016年开始,全微创食管切除术(TMIE)和开放式食管切除术(OE)的区别,研究显示两组患者术后复发率和死亡率无统计学差异,而TMIE组手术时间更长,但平均住院时间较短。其他有研究显示TMIE术后二次手术率较高,而开放式食管切除术(OE)术后伤口感染、肠梗阻和需要输血治疗概率更高。全微创食管切除术(TMIE)手术时间较长,以及患者二次手术比例较高,可能是由于该术式的学习曲线较长的原因。研究证实全微创食管切除术(TMIE)是安全的,其发病率和死亡率与开放式食管切除术(OE)相当[16]。
现有的人群研究很少涉及全微创食管切除术(TMIE)与开放式食管切除术(OE)长期生存率的比较。但在一项芬兰的人群研究中,全微创食管切除术(TMIE)与开放式食管切除术(OE)相比,5年生存率有所改善,而术后30天和90天死亡率两组没有显著差异[15]。在最近发表的一项研究中,将全微创食管切除术(TMIE)的临床研究结果与荷兰人群研究的DUCA注册数据进行比较发现[17]:全微创食管切除术(TMIE)术后发生全身性及肺部并发症的风险增加,但全微创食管切除术(TMIE)术后R0切除率更高、淋巴结清扫范围更大、术后30天死亡率更低[17]。
总而言之,迄今为止唯一一项随机临床对照研究比较了开放式食管切除术(OE)与常规非机器人全微创食管切除术(TMIE),该研究表明全微创食管切除术(TMIE)降低了肺部感染的风险,患者术后获得更好的短期和中期健康相关生活质量(HRQOL),以及达到了与开放式手术相似的淋巴结清扫数目,而后者可能是改善预后或至少不违背肿瘤学原则的一个重要指标。有些大规模人群队列研究得出了模棱两可的结论,在某些研究中甚至提示全微创食管切除术(TMIE)术后短期预后更差,全微创食管切除术(TMIE)往往手术时间较长、二次手术风险较高,这可能在一定程度上反映了微创食管切除术的学习曲线更长。
杂交微创食管切除术与开放式食管切除术的比较
杂交微创食管切除术(HMIE)的定义是在同一台手术中采用开放式和腔镜相结合的手术技术,如腹腔镜联合开胸或开腹联合胸腔镜。主要是Ivor Lewis食管切除术,腔镜按照传统的开胸手术入路,通过杂交方式来完成手术,其中腔镜下食管—胃胸内吻合术是杂交微创食管切除术——Ivor Lewis术式的主要学习曲线和障碍之一。多项研究表明,腹腔镜与开腹手术相比,术后呼吸功能明显改善[22,23]。众所周知,上腹部正中切口开腹和开胸术一样显著影响呼吸功能,因此两者的结合可能是开放式食管切除术(OE)术后并发症发生率较高的原因[24,25]。基于膈肌两侧的较大手术切口将导致术后并发症增加这一假设,诞生了杂交微创食管切除术。因为在杂交微创食管切除术中应用胸腔镜或者腹腔镜均可降低术后并发症发生的风险[26]。在微创食管切除术的发展历程中,杂交微创食管切除术在很多中心被广泛应用。
MIRO试验是近期发表的一项比较杂交微创食管切除术和开放式食管切除术的RCT研究,该研究纳入了中段或下段食管癌患者。主要研究终点为术中或术后30天内出现Clavien-Dindo分级Ⅱ级以上的并发症。2009年10月至2012年4月,共有207例患者被随机分配至杂交微创组或开放式手术组。其中杂交微创组共有37例(36%)患者出现Clavien-Dind分级Ⅱ级以上并发症,而开放式手术组为67例(64%)患者(OR:0.31;95 %可信区间:0.18~0.55;P<0.001)。杂交微创食管切除术后肺部主要并发症比开放式手术组减少,分别为18%和30%。杂交微创组3年总生存率为67%(95% CI,57~75 ),开放式手术组为55%(95% CI,45~64),但两组差异无统计学意义[2]。与开放式手术组相比,杂交组术后30天的健康相关生活质量(HRQOL)显著提高[27],特别是在角色功能和社会功能领域[27];MIRO试验对杂交微创食管切除和开放式食管切除的研究结果与大多数队列研究结果基本一致[28]。
总之,目前发表的唯一一项RCT研究和基于人口的队列研究结果一致认为,与开放式手术相比,杂交微创手术改善了患者术后短期效果,而且该术式的肿瘤学相关预后至少不劣于开放式手术。
机器人辅助微创食管切除术
机器人辅助手术的应用前景广阔,其通过提高操控性和可视化来增加解剖的准确性,显示出了巨大的潜力。达芬奇机器人系统已广泛应用于泌尿外科、直肠癌手术、妇科等领域。其主要优势是机器人手臂可以安装多个关节,从而相对于在常规的腹腔镜器械基础上提高了灵巧度。这些关节的精密动作可准确模拟开放式手术技术,同时具有手术入路创伤最小化的重要优势。与其他微创技术相比,机器人辅助微创技术具有的优势尚待进一步阐明。特别是与传统手术相比,机器人手术相关的成本增加方面。与传统的微创食管切除相比,增加的费用今后可能被出血量的进一步减少、术后并发症降低及住院时间缩短所抵消[29]。
2016年发表的一项基于人群研究的亚组分析中,机器人辅助微创食管切除与其他微创食管切除术进行了比较,结果显示,机器人组与其他微创组在R0切除率、淋巴结清扫个数、住院时间、术后30天再入院率及术后30天死亡率方面无统计学差异。有趣的是该研究显示,按组织学类型分层分析后发现,微创组和机器人组在腺癌患者的术后3年生存率方面无显著差异,而机器人手术组中鳞状细胞癌患者术后2年生存率明显优于其它微创手术组[3]。
2019年的一项研究分析了微创食管切除术和机器人辅助食管切除术中转开胸的影响因素,以及中转开胸后对预后的影响。机器人手术组共有5.2%的患者中转开胸或开腹,而微创组中转率为12.0%,且随着研究时间的推移,两种术式的中转均明显下降,提示两种术式均需要一定时间的学习曲线。随着病例的数累积,机器人手术组中转开放的比例下降更快,提示机器人手术组比常规微创手术组学习曲线更短。而中转开放手术组患者90天死亡率增加、住院时间延长及非计划再次入院率升高[5]。
一项来自韩国2019年的鳞状细胞癌手术倾向性评分队列研究显示,短期效果方面,开放式手术组肺炎发生率更高、术后对血管升压药的需求更高、疼痛程度更剧烈及短期HRQOL评分更差。长期生存方面,开放式手术组的死亡率更高且无病生存率(DFS)低于机器人手术组[6];与开放式手术组相比,机器人手术组的失血量更低、术后疼痛更轻、住院时间更短及术后需要重症监护的时间也更短[30,31]。
最近发表的首个机器人辅助手术与开放式手术比较的RCT试验,即ROBOT试验,是一项来自Utrecht的单中心临床研究。该研究的设计类似于微创手术和开放手术比较的随机对照试验,作者将112例食管癌患者随机分为机器人辅助McKeown术式组和开放手术的三切口McKeown术式组[18],主要的研究终点是Clavien-Dind评分为Ⅱ至Ⅴ期的术后并发症,结果发现机器人手术组为59%,发生率明显低于开放式手术组的80%(P=0.02),且机器人手术组术后功能恢复和短期HRQOL评估也更好。
总之,机器人辅助微创食管切除术后早期预后似乎与微创食管切除术相当,与开放式手术相比也有其优势。一些研究表明机器人辅助手术可能优于其他微创食管切除术,但目前尚无足够高质量数据支持,仍需在今后的研究中进一步评估。
讨论
本综述纳入的大多数研究表明,微创外科技术与食管及胃食管交界部肿瘤的预后改善情况有关,这在一定程度上可能受到微创手术组中病例选择及残余混杂的偏倚影响。有趣的是迄今为止发表的3个随机对照研究的结果与人群研究的数据之间存在差异,随机对照试验的结果都非常清楚地显示微创食管切除术后短期预后较好,而基于人群的研究数据相反,提示微创食管切除术后全身和肺部并发症发生率更高。这种差异可能反映了随机对照临床试验不能广泛开展的原因,因为这些研究通常在特定的患者群体和特定的医学中心中进行。因此,基于人群的研究是一个重要的补充,反映了除特定的临床研究中心之外,复杂的新技术在广泛实施方面可能遇到的困难。
更好的术后短期效果、呼吸道并发症风险的降低和住院时间的缩短,都是重要的研究进展[8,12,13],这些研究发现微创手术组在淋巴结清扫数目、改善了患者术后长期生存率方面[4,6,15,32]是有希望的,但仍不成熟,需要在大规模、设计完善的人群研究中加以证实,或至少在大规模、多中心的随机三期临床试验中加以证实。
微创食管切除术的弊端也不容忽视,与开放式手术相比,微创食管切除手术操作复杂、吻合口瘘的风险较高、再手术率较高。以及学习曲线时间较长[33]。本综述高度关注高质量的科学证据,仅包含了RCT研究和相互对照的队列研究。本综述的局限性包括该领域的RCT研究数量相对较少,以及大多数研究未能使用标准化的术后并发症描述 [34]。
总之,现有的A级证据表明,微创手术技术可降低术后并发症。MIRO试验甚至表明,和开放式手术相比,杂交微创手术在食管和胃食管交界部肿瘤的应用中,杂交微创手术患者的术后生存可能得到改善。但微创食管切除术的学习曲线需要被关注,以避免经验不足的外科医生和中心在引入该技术之初对患者造成不必要的伤害。机器人手术是微创食管切除技术的改进,如果这种改进与食管癌治疗的预后相关,则需要进一步的深入研究。未来想要获得更好的预后和更低的死亡率,这有待于微创食管切除手术技术的进一步发展和进步。
Acknowledgments
We would like to acknowledge Heidi Simosdotter Marlisto and Eva Fjellgren at the Karolinska University Hospital Library in Solna and Huddinge, respectively. They were of great assistance in the electronic literature search.
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Sjoerd Lagarde, Bas Wijnhoven, and Florian Lordick) for the series “Novel Developments in the Multimodality Treatment of Esophageal Cancer” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at: http://dx.doi.org/10.21037/aoe-2020-03). The series “Novel Developments in the Multimodality Treatment of Esophageal Cancer” was commissioned by the editorial office without any funding or sponsorship. MN serves as an unpaid editorial board member of Annals of Esophagus from Feb 2020 to Jan 2022. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Cuschieri A, Shimi S, Banting S. Endoscopic oesophagectomy through a right thoracoscopic approach. J R Coll Surg Edinb 1992;37:7-11. [PubMed]
- Mariette C, Markar SR, Dabakuyo-Yonli TS, et al. Hybrid Minimally Invasive Esophagectomy for Esophageal Cancer. N Engl J Med 2019;380:152-62. [Crossref] [PubMed]
- Yerokun BA, Sun Z, Yang CFJ, et al. Minimally Invasive Versus Open Esophagectomy for Esophageal Cancer: A Population-Based Analysis. Ann Thorac Surg 2016;102:416-23. [Crossref] [PubMed]
- Mitzman B, Lutfi W, Wang CH, et al. Minimally Invasive Esophagectomy Provides Equivalent Survival to Open Esophagectomy: An Analysis of the National Cancer Database. Semin Thorac Cardiovasc Surg 2017;29:244-53. [Crossref] [PubMed]
- Halpern AL, Friedman C, Torphy RJ, et al. Conversion to open surgery during minimally invasive esophagectomy portends worse short-term outcomes: an analysis of the National Cancer Database. Surg Endosc 2020;34:3470-78. [Crossref] [PubMed]
- Yun JK, Chong BK, Kim HJ, et al. Comparative outcomes of robot-assisted minimally invasive versus open esophagectomy in patients with esophageal squamous cell carcinoma: a propensity score-weighted analysis. Dis Esophagus 2020;33:doz071. [Crossref] [PubMed]
- Maas KW, Cuesta MA, van Berge Henegouwen MI, et al. Quality of Life and Late Complications After Minimally Invasive Compared to Open Esophagectomy: Results of a Randomized Trial. World J Surg 2015;39:1986-93. [Crossref] [PubMed]
- Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomisedcontrolled trial. Lancet 2012;379:1887-92. [Crossref] [PubMed]
- Maas KW, Biere SS, van Hoogstraten IM, et al. Immunological changes after minimally invasive or conventional esophageal resection for cancer: a randomized trial. World J Surg 2014;38:131-7. [Crossref] [PubMed]
- Mamidanna R, Bottle A, Aylin P, et al. Short-term outcomes following open versus minimally invasive esophagectomy for cancer in England: a population-based national study. Ann Surg 2012;255:197-203. [Crossref] [PubMed]
- Yoshida N, Yamamoto H, Baba H, et al. Can Minimally Invasive Esophagectomy Replace Open Esophagectomy for Esophageal Cancer? Latest Analysis of 24,233 Esophagectomies From the Japanese National Clinical Database. Ann Surg 2020;272:118-24. [Crossref] [PubMed]
- Takeuchi H, Miyata H, Ozawa S, et al. Comparison of Short-Term Outcomes Between Open and Minimally Invasive Esophagectomy for Esophageal Cancer Using a Nationwide Database in Japan. Ann Surg Oncol 2017;24:1821-7. [Crossref] [PubMed]
- Kauppila JH, Helminen O, Kytö V, et al. Short-Term Outcomes Following Minimally Invasive and Open Esophagectomy: A Population-Based Study from Finland and Sweden. Ann Surg Oncol 2018;25:326-32. [Crossref] [PubMed]
- Helminen O, Kytö V, Kauppila JH, et al. Population-based study of anastomotic stricture rates after minimally invasive and open oesophagectomy for cancer. BJS Open 2019;3:634-40. [Crossref] [PubMed]
- Sihvo E, Helminen O, Gunn J, et al. Long-term outcomes following minimally invasive and open esophagectomy in Finland: A population-based study. Eur J Surg Oncol 2019;45:1099-104. [Crossref] [PubMed]
- Sihag S, Kosinski AS, Gaissert HA, et al. Minimally Invasive Versus Open Esophagectomy for Esophageal Cancer: A Comparison of Early Surgical Outcomes From The Society of Thoracic Surgeons National Database. Ann Thorac Surg 2016;101:1281-8; discussion 1288-9. [Crossref] [PubMed]
- Markar SR, Ni M, Gisbertz SS, et al. Implementation of Minimally Invasive Esophagectomy From a Randomized Controlled Trial Setting to National Practice. J Clin Oncol 2020;38:2130-9. [Crossref] [PubMed]
- van der Sluis PC, van der Horst S, May AM, et al. Robot-assisted Minimally Invasive Thoracolaparoscopic Esophagectomy Versus Open Transthoracic Esophagectomy for Resectable Esophageal Cancer: A Randomized Controlled Trial. Ann Surg 2019;269:621-30. [Crossref] [PubMed]
- Straatman J, van der Wielen N, Cuesta MA, et al. Minimally Invasive Versus Open Esophageal Resection: Three-year Follow-up of the Previously Reported Randomized Controlled Trial: the TIME Trial. Ann Surg 2017;266:232-6. [Crossref] [PubMed]
- Nilsson M, Kamiya S, Lindblad M, et al. Implementation of minimally invasive esophagectomy in a tertiary referral center for esophageal cancer. J Thorac Dis 2017;9:S817-25. [Crossref] [PubMed]
- Bailey L, Khan O, Willows E, et al. Open and laparoscopically assisted oesophagectomy: a prospective comparative study. Eur J Cardiothorac Surg 2013;43:268-73. [Crossref] [PubMed]
- Coelho JC, de Araujo RP, Marchesini JB, et al. Pulmonary function after cholecystectomy performed through Kocher’s incision, a mini-incision, and laparoscopy. World J Surg 1993;17:544-6. [Crossref] [PubMed]
- Frazee RC, Roberts JW, Okeson GC, et al. Open versus laparoscopic cholecystectomy. A comparison of postoperative pulmonary function. Ann Surg 1991;213:651-3; discussion 653-4. [Crossref] [PubMed]
- Ford GT, Whitelaw WA, Rosenal TW, et al. Diaphragm function after upper abdominal surgery in humans. Am Rev Respir Dis 1983;127:431-6. [Crossref] [PubMed]
- Simonneau G, Vivien A, Sartene R, et al. Diaphragm dysfunction induced by upper abdominal surgery. Role of postoperative pain. Am Rev Respir Dis 1983;128:899-903. [PubMed]
- Voron T, Lintis A, Piessen G. Hybrid esophagectomy. J Thorac Dis 2019;11:S723-7. [Crossref] [PubMed]
- Mariette C, Markar S, Dabakuyo-Yonli TS, et al. Health-related Quality of Life Following Hybrid Minimally Invasive Versus Open Esophagectomy for Patients With Esophageal Cancer, Analysis of a Multicenter, Open-label, Randomized Phase III Controlled Trial: The MIRO Trial. Ann Surg 2020;271:1023-9. [Crossref] [PubMed]
- Glatz T, Marjanovic G, Kulemann B, et al. Hybrid minimally invasive esophagectomy vs. open esophagectomy: a matched case analysis in 120 patients. Langenbecks Arch Surg 2017;402:323-31. [Crossref] [PubMed]
- Boone J, Schipper MEI, Moojen WA, et al. Robot-assisted thoracoscopic oesophagectomy for cancer. Br J Surg 2009;96:878-86. [Crossref] [PubMed]
- Sarkaria IS, Rizk NP, Goldman DA, et al. Early Quality of Life Outcomes After Robotic-Assisted Minimally Invasive and Open Esophagectomy. Ann Thorac Surg 2019;108:920-8. [Crossref] [PubMed]
- Jeong DM, Kim JA, Ahn HJ, et al. Decreased Incidence of Postoperative Delirium in Robot-assisted Thoracoscopic Esophagectomy Compared With Open Transthoracic Esophagectomy. Surg Laparosc Endosc Percutan Tech 2016;26:516-22. [Crossref] [PubMed]
- Gottlieb-Vedi E, Kauppila JH, Malietzis G, et al. Long-term Survival in Esophageal Cancer After Minimally Invasive Compared to Open Esophagectomy: A Systematic Review and Meta-analysis. Ann Surg 2019;270:1005-17. [Crossref] [PubMed]
- van Workum F, Stenstra MHBC, Berkelmans GHK, et al. Learning Curve and Associated Morbidity of Minimally Invasive Esophagectomy: A Retrospective Multicenter Study. Ann Surg 2019;269:88-94. [Crossref] [PubMed]
- Low DE, Alderson D, Cecconello I, et al. International Consensus on Standardization of Data Collection for Complications Associated With Esophagectomy: Esophagectomy Complications Consensus Group (ECCG). Ann Surg 2015;262:286-94. [Crossref] [PubMed]

闵先军
中国航天科工集团七三一医院胸外科副主任,外科第三支部书记,师从王俊院士和李辉教授,四次登上国际胸外科专业顶级大会的舞台(14th WCLC、50th STS、13th ISSS 和2020年ASCO年会);曾获得北京市海淀区“知识型职工标兵”、北京市海淀区“学习之星”、“首都市民学习之星”等荣誉称号。(更新时间:2021/9/6)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Jebril W, Klevebro F, Rouvelas I, Nilsson M. Open, hybrid or total minimally invasive esophagectomy; a comprehensive review based on a systematic literature search. Ann Esophagus 2021;4:9.