
Siewert II型胃食管交界部癌的手术治疗:食管切除术、全胃切除术还是其他选择?
前言
胃食管交界部(Gastroesophageal junction,GEJ)癌的分子和解剖学起源几十年来一直存在重大争议,导致患者的最佳治疗方式尚未形成共识。Siewert和Stein认识到GEJ癌解剖学分类的必要性,并提出根据肿瘤中心的解剖位置将其分为三型以促进GEJ癌的研究和治疗[1]。Siewert分型(图1)已获得全球临床医生的广泛认可,几乎在全球范围内得到广泛应用,直接影响了肿瘤分期和治疗策略。Siewert Ⅰ型肿瘤通常被认为是食管癌而接受新辅助治疗和外科手术,而Ⅲ型肿瘤通常作为胃癌接受治疗[2]。但“真正的”GEJ,即Siewert Ⅱ型GEJ的最佳手术方式仍然存在较大争议。
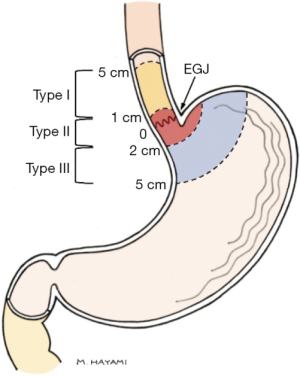
GEJ肿瘤准确分型的困难使得食管切除术和胃切除术之间的选择变得复杂。内镜检查、超声内镜及计算机断层扫描用于确定肿瘤位置的准确性有限[3]。大块型的肿瘤尤其难以分型;即使准确分型也可能与手术选择无关[3,4]。任何以根治为目的的肿瘤外科手术的主要长期目标都是完全切除肿瘤,包括区域淋巴结,从而最大限度地降低复发风险并延长总生存期(overall survival,OS)。几项比较胃切除术和食管切除术治疗GEJ癌的研究显示两者OS无差异[5-7]。此外,对比不同术式的胃切除术和食管切除术治疗GEJ癌的研究也未发现显著的OS差异[8-11]。现有证据表明,就OS而言,一种术式并不确定优于另一种术式。然而,不同术式的术后并发症风险、住院时间、无瘤生存期(disease-free survival,DFS)及淋巴结清扫数量可能存在差异,这值得进一步讨论。因此,本研究对已发表的文献进行了全面回顾分析,旨在指导局部晚期、非远处转移性GEJ癌在食管切除术和胃切除术之间的术式选择。
Ⅱ型GEJ癌的手术治疗
多年来,手术切除肿瘤是GEJ癌患者的主要根治方法。通常的手术方式包括食管切除联合近端胃切除或胃切除联合远端食管切除。食管切除术在西方国家较为常用,而胃切除术在日本、韩国和其他东亚国家较常使用,但两者之间的优劣差别尚不明确[11]。此外,这两种手术尚有多样的术式。无论采用何种术式,切缘阴性(R0)的完整肿瘤切除具有最高的预后价值,成为肿瘤外科的主要目标[12]。实现R0切除的患者五年生存率为43%~52%,而切缘阳性患者五年生存率只有11%~31%[13,14]。此外,由于局部淋巴结转移风险高,充分的淋巴结清扫也是重中之重。扩大淋巴结清扫可能导致手术并发症增多,这使得平衡广泛和局限的淋巴结清扫变得至关重要。手术方式的选择不仅要实现满意的肿瘤学结果,还要最大限度地减少手术创伤及其对术后恢复和健康相关生活质量的影响。
食管切除术——不同的术式会影响治疗结局吗?
迄今为止,食管切除术是西方国家治疗Ⅱ型GEJ癌最常见的手术方式。由于临床实践中Siewert分型困难,一些Ⅲ型GEJ癌患者也接受了食管切除术。目前应用的两种主要的食管切除术是经胸食管切除术(Ivor Lewis或三切口McKeown)和经裂孔食管切除术[11]。
荷兰的一项随机临床试验在未接受新辅助治疗的患者中比较了经胸(n=114)与经裂孔食管切除术(n=106)治疗I型和II型GEJ癌的效果。经胸食管切除术的围手术期并发症高于经裂孔食管切除术。经胸食管切除术术后肺部并发症发生率为57%,而经裂孔手术术后肺部并发症发生率为27%。经胸食管切除术术后的乳糜瘘发生率和机械通气时间显著增加,重症监护室停留时间和住院时间也显著延长。然而,两种术式的院内死亡率没有差别。经胸食管切除术的平均淋巴结清扫数量显著多于经裂孔食管切除术(分别31±14和16±9,P<0.001)。在中等数量淋巴结转移(1~8个阳性)患者中,经胸手术术后局部复发率较经裂孔手术降低20%;而对于无淋巴结转移或淋巴结转移超过8个的患者两种术式的局部复发率并无差异。两术式环周切缘阴性率无差异。两种术式的DFS和OS均无显著差异,但DFS和OS曲线随着时间延长出现分歧,即经胸食管切除术呈现更好的生存趋势,在Siewert Ⅱ型GEJ癌中体现的更为明显[9,10]。
英国的一项前瞻性队列研究纳入了664名接受经裂孔(n=263)或经胸(n=401)食管切除术的I型或II型GEJ癌患者;其中,经胸手术包括右胸联合开腹手术(n=325)及左胸腹联合入路手术(n=76)。经裂孔手术组新辅助化疗比例为78.1%,经胸手术组新辅助化疗比例为47.1%。两术式的OS及肿瘤复发均无显著差异。经胸手术清扫淋巴结数量显著高于经裂孔手术(中位数为20vs13,P<0.001)。两术式R0切除率没有差异,但在T3和T4期肿瘤的亚组分析中,经胸食管切除组阴性切缘率有增高的趋势,尽管差异并无统计学意义。与经胸食管切除术相比,经裂孔食管切除术术后的院内死亡率较低,但差异无统计学意义,经裂孔食管切除术术后中位住院时间显著缩短。术后并发症的数据则未见汇报[15]。
一项基于全美住院患者样本数据库的前瞻性队列研究纳入了11 914例接受经裂孔食管切除术的患者和5 481例接受经胸食管切除术的患者。两术式在住院时间或总体并发症方面没有显著差异。此外,两种术式在纵隔感染、切口感染、心血管或肺部并发症的发生率上亦没有显著差异[16]。
一项基于美国外科医师学会国家外科质量改进项目(ACS-NSQIP)数据库的队列研究纳入2005至2011年间接受治疗的1 428例食管癌患者。其中750例接受了经裂孔食管切除术,678例接受了经胸食管切除术。与经裂孔组相比,经胸组手术时间显著延长,再次手术率增加,但两组住院时间相似。经胸和经裂孔切除术术后的总体严重并发症的发生率相似。此外,两组在肺、肾、心脏、血栓栓塞或脓毒症等并发症方面的差异无统计学意义。与经裂孔食管切除术相比,经胸手术术后30天死亡率略高,但差异无统计学意义[17]。
一项荟萃分析纳入了7 527例因食管癌或GEJ接受经裂孔或经胸食管切除术的患者,结果显示两术式3年及5年OS无差异。与经裂孔切除术相比,经胸切除术的院内死亡率显著增高。经胸食管切除术术后肺部并发症、乳糜瘘和切口感染明显增多,而经裂孔食管切除术术后吻合口瘘和声带损伤更常见。经胸切除术术后重症监护室停留时间和住院时间均显著延长[18]。最近的一项荟萃分析也比较了经胸和经裂孔食管切除术治疗GEJ癌的效果,发现两术式OS无差异。然而,经胸手术组的30天死亡率和住院时间高于经裂孔手术组。两组清扫淋巴结数量没有差别。经胸手术组肺部并发症明显增加,但两组心血管并发症没有差异。与前一个荟萃分析不同的是两术式吻合口漏发生率无差异[19]。
我们分析认为II型GEJ癌接受食管切除术的标准术式应该是两切口Ivor Lewis食管切除加2野淋巴结清扫。现有的弱证据表明这一术式对于合适的患者具有一些肿瘤学优势并且不会显著增加手术风险。经裂孔食管切除术可能主要用于经胸手术显著增加围术期风险的患者,如合并其他疾病,尤其是严重慢性肺病的患者。伴有上纵隔淋巴结转移的II型GEJ癌则可能需要接受McKeown三切口食管切除术。
胃切除术
全胃切除加D2淋巴结清扫是治疗II型GEJ癌的有效术式,尤其在亚洲应用广泛[20,21]。实施胃切除术时对下纵隔淋巴结进行经裂孔切除是可能实现的,但并不能实现对下肺静脉以上淋巴结的系统性清扫。
近端胃切除术主要在亚洲用于治疗T1b肿瘤。尽管这一术式最多只能实现D1+淋巴结清扫,其肿瘤学结局仍是可接受的。一项大型回顾性队列研究纳入了2 217例患者,其中1 584(71.4%)例患者接受了全胃切除术,633(28.6%)例患者接受了近端胃切除术。总体而言,全胃切除术较近端胃切除术的OS略高,而DFS差异无统计学意义[22,23]。
一项单中心回顾性队列研究纳入了423例接受近端或全胃切除的II型或III型GEJ癌患者。两术式5年OS没有差异。全胃切除术清扫淋巴结数量显著多于近端胃切除术,两者淋巴结转移比例分别为12%和3.4%[24]。许多研究报告了近端胃切除术术后的严重反流问题[24,25]。这一问题最近已通过空肠间置[26]得以成功解决,代表技术包括双通道重建和食管胃活瓣技术[27,28]。
总之,胃切除术可用于治疗II型GEJ癌。局部晚期(cT2-cT4,淋巴结阳性)II型GEJ癌的治疗应采用全胃切除术而非近端胃切除术。近端胃切除加空肠间置或食管胃活瓣技术可用于早期肿瘤治疗。胃切除术的局限性在于难以实现对下纵隔以外的胸内淋巴结清扫。
左胸腹联合食管胃切除术
日本的一项随机对照试验将II型或III型GEJ癌患者随机分组后接受腹部扩大全胃切除术加下纵隔经裂孔淋巴结清扫或左胸腹联合食管胃切除术。该研究第一次中期分析显示左胸腹联合食管胃切除术与腹部扩大全胃切除术相比,未能提高术后生存率,遂终止该项研究。经腹全胃切除术术后5年OS较左胸腹联合食管胃切除术提升14.4%,但差异无统计学意义。两术式术后并发症总体上没有差异,但左胸腹联合术后呼吸系统并发症显著增加[8]。
一项同样来自亚洲的回顾性队列研究纳入了接受左胸腹联合或经腹胃切除的II型GEJ癌患者。经腹胃切除较左胸腹联合食管胃切除术后生存率呈现提高的趋势,但差异无统计学意义。两组中的一些患者接受了近端胃切除,但作者并未汇报这一人群的亚组分析结果。相较左胸腹联合食管胃切除术,经腹胃切除术淋巴结清扫数量更多、手术时间更短、住院时间更多。两组切缘阴性率相似。左胸腹联合食管胃切除术术后并发症几乎是经腹胃切除术的两倍,两者分别为28.4%和14.3%。然而两组术后30天内死亡率无显著差异[21]。在另一项大型多中心回顾性队列研究中,左胸腹联合食管胃切除术治疗食管和交界部肿瘤的术后死亡率低于Ivor Lewis食管切除术,但两者长期和无瘤生存期相似[29]。
左胸腹联合食管胃切除术为到达GEJ部位提供了良好入路。与经腹胃切除术相比,该术式术后并发症和长期不良症状增加,这在亚洲人群中尤为明显。但其肿瘤学结局似乎与食管切除术和胃切除术相似。左胸腹联合食管胃切除术适用于大块型肿瘤,尤其是西方肥胖患者。这一术式也适用于无法利用胃重建消化道而需要长时间进行Roux-en-Y食管空肠吻合的情况。目前仍无法应用微创技术实现左胸腹入路手术。
哪种术式是II型GEJ癌的最佳术式?
II型GEJ癌的最佳术式是食管切除术、胃切除术或者左胸腹联合食管胃切除术尚不明确。三种术式均显示出相似的肿瘤学结局。当前的文献未能提供确凿证据以解决最佳术式方面的争议。
Martin及其同事发表了一项纳入4 996例II型GEJ癌患者的大型回顾性队列研究。该研究包括1 181例患者,其中214例(18.2%)接受胃切除术,967例(81.8%)接受食管切除术。两术式术后30天死亡率及术后并发症没有差异。两术式间诸如肺炎和再插管的呼吸系统并发症也无差异。另一项队列研究纳入了2 714(71.1%)例接受食管切除术的患者和1 102(28.9%)例接受胃切除术的患者。食管切除术较胃切除术的中位OS显著延长(26个月vs21个月,P=0.025)。然而,多因素分析显示手术方式不是OS的独立预测因素[5]。
最近发表的一项回顾性队列研究分析了接受全胃切除术或食管切除术的II型GEJ癌患者的围术期和长期结局。大约一半的患者为局部晚期肿瘤(cT3/4或cN+)并接受了新辅助化疗。两术式总体并发症、吻合口瘘、肺部并发症和心脏并发症相似。两术式切缘阴性率、院内死亡率和30天死亡率没有差异,然而食管切除术术后住院时间显著延长。两术式获取淋巴结的中位数均为24,其转移淋巴结中位数也无显著差异。胃切除术较食管切除术5年OS显著下降(57.5% vs 69.6%,P=0.02)。食管切除术术后5年DFS也显著优于胃切除术(79.1% vs 44.8%,P=0.002)。食管切除术的优势主要见于cT3-T4或临床淋巴结阳性患者,即淋巴结转移风险高的患者[30]。
欧洲的一项小型回顾性研究纳入了未接受新辅助治疗的II型GEJ癌患者,其结果表明食管切除术较胃切除术术后无复发生存期显著缩短。此外,单因素和多因素Cox回归分析结果表明手术方式是无复发生存期最强的独立预测因素,而胃切除术是其中的有利条件[31]。
荷兰的一项单中心回顾性队列研究比较了胃切除术和食管切除术对GEJ癌的治疗结局,其中包含176例II型GEJ 癌患者。两术式的30天死亡率和总体死亡率没有显著差异。两术式在总体并发症、肺炎及吻合口瘘方面没有显著差异。两术式的中位住院时间和重症监护室停留时间相似。与食管切除术相比,胃切除术术后切缘阳性率显著增加(29% vs 11%,P=0.025),但两术式5年OS无显著差异。此外,胃切除术和食管切除术在DFS及复发率方面没有差异[32]。
一项前瞻性队列研究比较了II型和III型GEJ癌患者的阴性切缘、淋巴结清扫和生存期。155例患者接受了食管切除术,85例患者接受了全胃切除术。两组切缘阳性率无显著差异。胃切除术和食管切除术清扫淋巴结的平均数量相似,术后5年OS也无差异[6]。一项回顾性研究在I~III型GEJ癌患者中比较了食管切除术和扩大胃切除术,发现两术式在切缘阴性率、住院时间及重症监护室停留时间方面没有显著差异。分别比较I、II和III型GEJ癌的食管切除术和胃切除术时,未观察到生存差异。此外,在II型GEJ癌患者的亚组分析中,任一术式均未观察到生存优势[2]。
讨论
指导II型GEJ癌最佳手术方法的高级别科学证据很少。无瘤切缘、充足的2野淋巴结清扫及高质量的消化道重建的基本手术原则决定了术式选择。II型GEJ癌胸内淋巴结转移风险较高,这使得经胸入路为经验丰富外科医生们所青睐。与经腹全胃切除术相比,左胸腹联合食管胃切除术在亚洲研究中术后并发症发生率较高,但也有此术式取得优异结果的报道[33]。此外,现有文献表明实施良好的下纵隔淋巴结清扫的腹部扩大胃切除术似乎可以实现类似的结果[21,34]。
上述3种手术方式不仅在手术并发症和术后恢复方面存在差异,在可清扫的淋巴结站别方面也存在重大差异。尽管淋巴结转移是最强预后因素之一,II型GEJ癌的淋巴结清扫范围尚未达成共识。Peyre等人进行的一项前瞻性国际多中心研究纳入了2 303例未经新辅助治疗并实现R0切除的食管癌患者[35]。淋巴结清扫的中位数为17个,清扫淋巴结的数量是生存的独立预测因素。清扫淋巴结数目的最佳阈值是≥23个。无论肿瘤分期如何,当淋巴结清扫数量达到这个阈值时,生存期都会显著提高。这一获益在III期肿瘤中最为显著。此外,在II期和III期肿瘤中,每多清扫10个淋巴结,患者5年生存率就会随之增加[35]。然而,在接受新辅助治疗的患者中,研究发现淋巴结清扫数量的增加并不能带来5年OS的提升[36,37]。此外,一项倾向评分匹配的多中心队列研究纳入了新辅助化疗或新辅助放化疗后接受手术的GEJ癌患者。结果表明淋巴结清扫并不影响新辅助放化疗组的术后生存或复发。另一方面,在新辅助化疗组中,当淋巴结清扫数量超过52个时,患者无瘤生存期和总体复发率将有所改善,尽管差异无统计学意义[38],且患者OS也获得提升。
总之,现有的科学证据不足以支持II型GEJ癌患者的标准化手术方式。包括食管切除术、胃切除术、左胸腹联合食管胃切除术在内的三种术式各有优劣。在可获取更有力证据之前,II型GEJ癌的诊疗机构可在食管切除术、经腹全胃切除术和左胸腹联合扩大胃切除术中做出个体化选择。多数既往研究的局限性在于非随机的研究设计,这会在术式之间引入选择偏倚而影响研究结果。正在进行的Cardia试验将II型GEJ癌患者以接受食管切除术或胃切除术随机分组,该研究一旦完成将成为该领域重要的证据。
Acknowledgments
To Professor Riccardo Rosati for the invitation to write this review.
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Riccardo Rosati) for the series “Current Issues on GEJ Adenocarcinoma” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at: http://dx.doi.org/10.21037/aoe-2020-geja-02). The series “Current Issues on GEJ Adenocarcinoma” was commissioned by the editorial office without any funding or sponsorship. MN serves as an unpaid editorial board member of Annals of Esophagus from Feb. 2018 to Jan. 2022. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg 1998;85:1457-9. [Crossref] [PubMed]
- Johansson J, Djerf P, Öberg S, et al. Two Different Surgical Approaches in the Treatment of Adenocarcinoma at the Gastroesophageal Junction. World J Surg 2008;32:1013-20. [Crossref] [PubMed]
- Grotenhuis BA, Wijnhoven BPL, Poley JW, et al. Preoperative Assessment of Tumor Location and Station-Specific Lymph Node Status in Patients with Adenocarcinoma of the Gastroesophageal Junction. World J Surg 2013;37:147-55. [Crossref] [PubMed]
- Curtis NJ, Noble F, Bailey IS, et al. The relevance of the Siewert classification in the era of multimodal therapy for adenocarcinoma of the gastro-oesophageal junction. J Surg Oncol 2014;109:202-7. [Crossref] [PubMed]
- Martin JT, Mahan A, Zwischenberger JB, et al. Should Gastric Cardia Cancers Be Treated with Esophagectomy or Total Gastrectomy? A Comprehensive Analysis of 4,996 NSQIP/SEER Patients. J Am Coll Surg 2015;220:510-20. [Crossref] [PubMed]
- Kauppila JH, Wahlin K, Lagergren J. Gastrectomy compared to oesophagectomy for Siewert II and III gastro-oesophageal junctional cancer in relation to resection margins, lymphadenectomy and survival. Sci Rep 2017;7:17783. [Crossref] [PubMed]
- Haverkamp L, Ruurda JP, van Leeuwen MS, et al. Systematic review of the surgical strategies of adenocarcinomas of the gastroesophageal junction. Surg Oncol 2014;23:222-8. [Crossref] [PubMed]
- Sasako M, Sano T, Yamamoto S, et al. Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial. Lancet Oncol 2006;7:644-51. [Crossref] [PubMed]
- Hulscher JBF, van Sandick JW, de Boer AGEM, et al. Extended Transthoracic Resection Compared with Limited Transhiatal Resection for Adenocarcinoma of the Esophagus. N Engl J Med 2002;347:1662-9. [Crossref] [PubMed]
- Omloo JMT, Lagarde SM, Hulscher JBF, et al. Extended Transthoracic Resection Compared With Limited Transhiatal Resection for Adenocarcinoma of the Mid/Distal Esophagus: Five-Year Survival of a Randomized Clinical Trial. Ann Surg 2007;246:992-1000. [Crossref] [PubMed]
- Kauppila JH, Lagergren J. The surgical management of esophago-gastric junctional cancer. Surg Oncol 2016;25:394-400. [Crossref] [PubMed]
- Klevebro F, Ekman S, Nilsson M. Current trends in multimodality treatment of esophageal and gastroesophageal junction cancer – Review article. Surg Oncol 2017;26:290-5. [Crossref] [PubMed]
- Feith M, Stein HJ, Siewert JR. Adenocarcinoma of the Esophagogastric Junction: Surgical Therapy Based on 1602 Consecutive Resected Patients. Surg Oncol Clin N Am 2006;15:751-64. [Crossref] [PubMed]
- O’Farrell NJ, Donohoe CL, Muldoon C, et al. Lack of Independent Significance of a Close (<1 mm) Circumferential Resection Margin Involvement in Esophageal and Junctional Cancer. Ann Surg Oncol 2013;20:2727-33. [Crossref] [PubMed]
- Davies AR, Sandhu H, Pillai A, et al. Surgical resection strategy and the influence of radicality on outcomes in oesophageal cancer. Br J Surg 2014;101:511-7. [Crossref] [PubMed]
- Connors RC, Reuben BC, Neumayer LA, et al. Comparing Outcomes after Transthoracic and Transhiatal Esophagectomy: A 5-Year Prospective Cohort of 17,395 Patients. J Am Coll Surg 2007;205:735-40. [Crossref] [PubMed]
- Papenfuss WA, Kukar M, Attwood K, et al. Transhiatal versus transthoracic esophagectomy for esophageal cancer: A 2005–2011 NSQIP comparison of modern multicenter results. J Surg Oncol 2014;110:298-301. [Crossref] [PubMed]
- Hulscher JBF, Tijssen JGP, Obertop H, et al. Transthoracic versus transhiatal resection for carcinoma of the esophagus: a meta-analysis. Ann Thorac Surg 2001;72:306-13. [Crossref] [PubMed]
- Wei MT, Zhang YC, Deng XB, et al. Transthoracic vs transhiatal surgery for cancer of the esophagogastric junction: A meta-analysis. World J Gastroenterol 2014;20:10183-92. [Crossref] [PubMed]
- Kim KT, Jeong O, Jung MR, et al. Outcomes of Abdominal Total Gastrectomy for Type II and III Gastroesophageal Junction Tumors: Single Center’s Experience in Korea. J Gastric Cancer 2012;12:36-42. [Crossref] [PubMed]
- Yang ZF, Wu DQ, Wang JJ, et al. Surgical approach for Siewert type II adenocarcinoma of the esophagogastric junction: transthoracic or transabdominal? —a single-center retrospective study. Ann Transl Med 2018;6:5. [Crossref]
- Zhu K, Xu Y, Fu J, et al. Proximal Gastrectomy versus Total Gastrectomy for Siewert Type II Adenocarcinoma of the Esophagogastric Junction: A Comprehensive Analysis of Data from the SEER Registry. Dis Markers 2019;2019:9637972 [Crossref] [PubMed]
- Yoo CH, Sohn BH, Han WK, et al. Proximal Gastrectomy Reconstructed by Jejunal Pouch Interposition for Upper Third Gastric Cancer: Prospective Randomized Study. World J Surg 2005;29:1592-9. [Crossref] [PubMed]
- An JY, Youn HG, Choi MG, et al. The difficult choice between total and proximal gastrectomy in proximal early gastric cancer. Am J Surg 2008;196:587-91. [Crossref] [PubMed]
- Yoo CH, Sohn BH, Han WK, et al. Long-term Results of Proximal and Total Gastrectomy for Adenocarcinoma of the Upper Third of the Stomach. Cancer Res Treat 2004;36:50-5. [Crossref] [PubMed]
- Kameyama J, Ishida H, Yasaku Y, et al. Proximal gastrectomy reconstructed by interposition of a jejunal pouch. Surgical technique. Eur J Surg 1993;159:491-3. [PubMed]
- Matsushiro T, Hariu T, Nagashima H, et al. Valvuloplasty plus fundoplasty to prevent esophageal regurgitation in esophagogastrostomy after proximal gastrectomy. Am J Surg 1986;152:314-9. [Crossref] [PubMed]
- Ahn SH, Jung DH, Son SY, et al. Laparoscopic double-tract proximal gastrectomy for proximal early gastric cancer. Gastric Cancer 2014;17:562-70. [Crossref] [PubMed]
- Davies AR, Zylstra J, Baker CR, et al. A comparison of the left thoracoabdominal and Ivor–Lewis esophagectomy. Dis Esophagus 2018;31:dox129 [Crossref] [PubMed]
- Blank S, Schmidt T, Heger P, et al. Surgical strategies in true adenocarcinoma of the esophagogastric junction (AEG II): thoracoabdominal or abdominal approach? Gastric Cancer 2018;21:303-14. [Crossref] [PubMed]
- Reeh M, Mina S, Bockhorn M, et al. Staging and outcome depending on surgical treatment in adenocarcinomas of the oesophagogastric junction. Br J Surg 2012;99:1406-14. [Crossref] [PubMed]
- Parry K, Haverkamp L, Bruijnen RCG, et al. Surgical Treatment of Adenocarcinomas of the Gastro-esophageal Junction. Ann Surg Oncol 2015;22:597-603. [Crossref] [PubMed]
- Markar SR, Schmidt H, Kunz S, et al. Evolution of Standardized Clinical Pathways: Refining Multidisciplinary Care and Process to Improve Outcomes of the Surgical Treatment of Esophageal Cancer. J Gastrointest Surg 2014;18:1238-46. [Crossref] [PubMed]
- Han WH, Eom BW, Yoon HM, et al. The optimal extent of lymph node dissection in gastroesophageal junctional cancer: retrospective case control study. BMC Cancer 2019;19:719. [Crossref] [PubMed]
- Peyre CG, Hagen JA, DeMeester SR, et al. The Number of Lymph Nodes Removed Predicts Survival in Esophageal Cancer: An International Study on the Impact of Extent of Surgical Resection. Trans Meet Am Surg Assoc 2008;126:190-7.
- Schaaf M van der, Johar A, Wijnhoven B, et al. Extent of Lymph Node Removal During Esophageal Cancer Surgery and Survival. JNCI J Natl Cancer Inst [Internet]. 2015 May [cited 2020 Mar 21];107(5). Available online: https://academic.oup.com/jnci/article-lookup/doi/10.1093/jnci/djv043
- Koen Talsma A, Shapiro J, Looman CWN, et al. Lymph Node Retrieval During Esophagectomy With and Without Neoadjuvant Chemoradiotherapy: Prognostic and Therapeutic Impact on Survival. Ann Surg 2014;260:786-92. [Crossref] [PubMed]
- Markar SR, Noordman BJ, Mackenzie H, et al. Multimodality treatment for esophageal adenocarcinoma: multi-center propensity-score matched study. Ann Oncol 2017;28:519-27. [Crossref] [PubMed]

王培宇
北京大学人民医院胸外科科研博士。从事肺癌、食管癌发病机制及诊断治疗的基础与临床研究。目前以第一作者在IJS、EJCTS、ASO等杂志发表SCI论文8篇,总IF为37.0。多次于ISDE、EACTS及全国胸心血管外科会议作发言和壁报交流。(更新时间:2021/7/27)

段晓峰
主治医师,医学博士,就职于天津医科大学肿瘤医院食管肿瘤微创外科。现担任吴阶平医学会模拟医学部胸外科专委会青年委员,天津市中西医结合学会临床营养治疗专委会青年委员,国际食管疾病协会(ISDE)会员,中国抗癌协会会员;同时担任《中华胸部外科电子杂志》中青年编委,《Annals of Thoracic Surgery》等SCI杂志审稿专家。2017年-2018年美国南卡罗莱纳州医科大学癌症中心访问学习。主持多项国家级及省部级课题。发表国内外学术论文30余篇。2020年CSCO UNDER35 优秀青年肿瘤医生。参编、参译《食管外科》、《食管癌诊断和治疗》等著作。(更新时间:2021/7/27)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Saliba G, Hayami M, Klevebro F, Nilsson M. Surgical treatment of Siewert type II gastroesophageal junction cancer: esophagectomy, total gastrectomy or other options? Ann Esophagus 2020;3:18.


