
贲门失弛缓症:指南演变的简要总结
方法
在PubMed上搜索关键词“贲门失弛缓症”“吞咽困难”和“指南”,有78篇符合纳入标准,随后筛选出12篇相关领域的指南或专家临床研究结果的更新,但不都是完全针对贲门失弛缓症的治疗。其中1篇文章仅涉及一所地方医院的经验和指南,故予排除[1]。表1以出版时间为序对纳入的指南进行汇总。
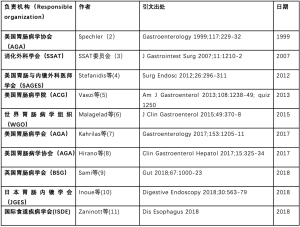
Full table
早期指南
贲门失弛缓症指南可追溯到20余年前,1999年Spechler等人[2]代表美国胃肠病协会(American Gastroenterological Association, AGA)发表了一份声明,详细介绍了吞咽困难患者的管理建议。在腹腔镜手术和经口内镜下肌切开术(per-oral endoscopic myotomy, POEM)等治疗方法普及前,AGA指南主张对所有疑似患者进行吞钡、测压和内镜检查,排除假性贲门失弛缓症。在此基础上,根据健康状况将患者分为适宜手术及不宜手术两类,并制定相应的管理策略。前者可接受外科手术或球囊扩张术治疗。指南发表期间,有报道称外科手术在一定程度上优于其他治疗,但存在费用高、恢复期长(开放性肌切开术)及术后胃食管反流病风险增加等缺点。指南未能明确是否推荐在肌切开术后行胃底折叠术。对于健康状况不佳的患者,在硝酸盐或钙通道阻滞药治疗失败后建议行探条扩张术治疗。有趣的是,与内镜球囊扩张术相比,探条扩张术对存在共病的人群的侵入性更小且耐受性更好。但目前的临床实践和证据建议已不再将探条扩张术作为首选治疗措施。
在这些早期指南发表后很长时间里,相关循证指南都处于空白。直到2007年,消化外科学会(SSAT)发布了患者护理指南[3]。作者在回顾历史后承认,球囊扩张术正成为贲门失弛缓症首选治疗方式。只有不能耐受球囊扩张的持续性吞咽困难患者及术后出现穿孔等并发症者才选择外科手术治疗。在这之后,腹腔镜下Heller’s肌切开术和部分胃底折叠术的出现彻底改变了这一治疗策略,成为大多数医生的首选。当时,仅有一项前瞻性随机试验对球囊扩张术和外科手术进行比较,发现与球囊扩张术相比,肌切开术疗效更好(65% vs 95%) [12]。指南发布前,一项随机对照试验[13]证实,在肌切开术中联合部分胃底折叠术(Dor或Toupet)能明显改善术后反流症状。因此,SSAT作者推荐将腹腔镜下Heller’s肌切开术联合部分胃底折叠术作为标准化治疗方案。
近10年的指南
在早期文献发布后,随着越来越多的数据支持,近10年共发布六篇国家或国际指南。
美国胃肠与内镜外科医师学会(SAGES)在2010年10月进行了一项系统性文献综述,根据检索标准纳入214篇文章。其2012年发布的指南[4]将证据质量分为极低、低、中、高四个等级,并把推荐强度分为强、弱两级。诊断三联金标准仍然是食管测压、内镜检查和食管钡剂造影。但治疗方案本质上侧重于控制症状,无法从根本的病理角度治疗疾病。药物治疗方面,平滑肌松弛剂(钙通道阻滞剂和长效硝酸盐制剂)等可通过降低食管下段括约肌压力并缓解吞咽困难,用于贲门失弛缓症的早期治疗。考虑到口服给药吸收率变异大并且无法预测,SAGES建议药物治疗的患者选择舌下制剂。
肉毒杆菌毒素可抑制运动神经元突触前末梢释放乙酰胆碱,经证实对贲门失弛缓症患者有效率高达85%。然而,SAGES分析文献后发现,肉毒杆菌毒素的疗效随时间延长明显减弱,2年后多数患者复发。因此,建议仅应用于不适合替代治疗的合并其他疾病的老年人群。
由于牵拉和分裂肌纤维的双峰效应,建议在硬性扩张前进行球囊扩张。作者承认,由于不同研究对预后评估的变异较大,很难比较并解释扩张效果。据报道,扩张后5年内吞咽困难缓解率为48%~78%,单次治疗后持续缓解率仅为13%。不同扩张器类型及是否经荧光镜引导对疗效无显著影响。然而,指南基于高水平证据对扩张相关并发症表示担忧,强烈建议仅将其应用于拒绝手术或不适合手术的患者。在上述指南发布时,POEM尚处于起步阶段,扩张治疗仍被视为最有效的非手术治疗策略。不推荐应用联合治疗和支架等其他非手术疗法。
SAGES指南明确将外科手术作为主要治疗方式。建议由具备相关经验的外科医生进行腹腔镜下部分胃底折叠术(与全包裹术相比,前部或后部效果相同)。POEM等新技术在指南发表时还处于起步阶段,相关建议需要更多证据支持。有趣的是,仅少量证据表明,肌切开术前的内镜治疗与预后不良相关。SAGES分析文献后,仍未证实高BMI、Ⅲ型贲门失弛缓症和术前食管下括约肌压力等因素对手术预后的预测价值。由于证据不足,对于初次手术治疗失败或复发的患者,作者没有提出明确的建议。
美国胃肠病学院(ACG)2013年的指南[5]采用的文献检索和纳入标准与SAGES指南的非常相似,二者的诊疗建议和结论也因此相近。可能与该组织的目标受众有关,ACG指南的作者没有充足证据证明肌切开术优于球囊扩张术,认为两者均具备良好的疗效。应根据患者因素(包括年龄、性别和患者偏好)和当地医疗机构的专业知识选择初始治疗方案,首选掌握各种治疗方案的大容量医疗中心就诊。指南基于两项比较Heller’ s肌切开术和球囊扩张术的权威研究。第一项中,Campos等人于2009年[14]进行了一项系统综述,共纳入3086名接受肌切开术和1065名接受球囊扩张术的患者。术后12个月时症状缓解率分别为89.3%和68.2%,36个月后缓解率为89.3%和56.3%。ACG指南的作者强调,球囊扩张术通常需重复应用以达到治疗效果,上述研究仅比较单次球囊扩张疗效,并不满足治疗标准。Boeckxstaens等人比较Heller’ s肌切开术和球囊扩张术的首例欧洲临床试验(2011年)[15],要求球囊扩张不超过三次,发现二者疗效没有显著差异。在指南发表时,POEM仍处于新兴阶段,主要用于临床试验。
2015年,世界胃肠病学组织(WGO)发布的吞咽困难全球指南[6]涵盖了贲门失弛缓症的管理策略。这份旨在提供治疗流程的指南指出,由于诊疗所需的全套设备尚未在全球范围内普及,在有限的条件下难以实现标准化管理。指南有关贲门失弛缓症的管理路径与此前的基本一致,但重点关注不同医疗机构的可用资源。虽然WGO指南在其预设背景下至关重要,但能为本文补充的信息有限。
POEM时代
在全球范围内,随着POEM的出现和普及,贲门失弛缓症管理指南开始大规模更新。在这期间,高分辨率测压能分级评估食管收缩力,从而深入了解各阶段贲门失弛缓症的病理特征。芝加哥分类系统对疾病的分类使得对不同疾病类型进行个体化管理成为可能。
也因此,2017年AGA临床更新指南[7]提倡“表型为导向”的治疗决策,将患者个体参数纳入考量。治疗前需明确患者有无食管裂孔疝、食管扩张或膈上憩室、高分辨率测压值及其相应的的芝加哥分类。对于Ⅲ型贲门失弛缓症患者,建议前往具备专业知识的大容量医疗中心接受POEM治疗。尽管当时对比肌切开术和POEM的证据不足,但指南认为二者在贲门失弛缓症的各个方面效果相当。同时还指出,POEM后患者食管反流风险升高,应于术前充分告知。
在2017年最后一次AGA临床实践更新中,内镜下功能性管腔成像探针(Endoscopic-Functional Lumen Imaging Probe, Endo-FLIP)这一新兴诊治辅助技术被关注重点[8]。Endo-FLIP并不能评估食管的收缩模式或食团传输能力,主要测定其机械特性,直接评估食管收缩力。早期数据表明,评估胃食管交界(Gastroesophageal junction, GEJ)功能可反映管腔开放程度,从而估测食管收缩力,为标准化研究提供有价值的信息。术中应用Endo-FLIP能帮助术者实时评估肌切开术的效果,从而制定手术决策。AGA推荐Endo-FLIP辅助贲门失弛缓症的诊断和(或)术中决策。
在2018年英国胃肠病学会(BSG)中,Sami等人发表了最新的食管扩张术治疗贲门失弛缓症的指南[9]。指南重点探讨食管扩张的技术性问题,未直接比较现有的各种治疗方案。其中,食管扩张被视为安全的治疗策略,建议常规进行三级扩张。普遍认为,借助荧光镜引导能提高手术安全性和疗效,但与单独内镜操作对比的数据不足。另外,不建议使用探条扩张术治疗贲门失弛缓症。
POEM相关指南
虽然AGA曾发布过POEM临床更新指南[7],但直到2018年,日本胃肠内镜学会(JGES)才发布了首个仅针对POEM的护理指南标准[10]。作者坦言,由于POEM的临床应用较晚,文献系统综述所纳入的患者数量较少且随访期较短,推荐强度相对较低。Akintoye等人对2 373名患者进行的国际性多中心荟萃分析[16]后,POEM疗效(98%的成功率)得到证实,并成为贲门失弛缓症的有效疗法。如前所述,高分辨率测压技术使得病程分层更精确,疾病不同亚型的治疗更具特异性。高分辨率测压能精准评估近端病变食管,但不可避免地延长了肌切开术时间。指南提出,POEM较腹腔镜肌切开术操作方便,推荐作为Ⅲ型患者的替代治疗方案。
在本文发表前的指南中,并未权衡初始治疗后复发患者的治疗抉择。JGES建议,在Heller’ s肌切开术或首次POEM术失败后选择再次行POEM术治疗,但需要更多数据对远期预后进行分层。尽管POEM不如首次治疗一样有效,且对于腹腔镜肌切开术后复发患者的疗效不明,但考虑到球囊扩张对上述患者无效,POEM仍具备应用价值。
老年较青年患病率增加4倍,由于其合并症增多且手术风险升高,疾病管理更为复杂。虽然POEM指南规定手术应在全麻下进行,但由于内镜手术的生理反应较小,对于老年患者,建议在缓解症状并规避手术风险的同时寻求更为积极的治疗方案。在老龄化日趋严重的背景下,这一决策具有重要意义。JGES指南建议深入评估相关领域,寻求更多的数据支持。
越来越多的证据表明,Heller’ s肌切开术和POEM术对症状缓解的效果相近,但POEM术后胃食管反流病的发生率更高。日本指南建议患者术后长期接受抗酸治疗,避免持续性食管反流。强烈建议与患者充分沟通,介绍各种方案及相关风险,使患者作出合理判断。目前还没有POEM术后随访的标准化策略,但JGES建议定期门诊随访并复查胃镜。
国际食道疾病学会“I-GOAL”指南
在2018年最新的权威性贲门失弛缓症管理著作中[11],国际食道疾病学会(ISDE)依靠完善的方法论和DELPHI共识,对11个国家51名专家的意见进行汇总。“I-GOAL”(ISDE-Guidelines for Oesophageal Achalasia)指南考虑到,由于目前胃肠病专家和外科医生均负责贲门失弛缓症的治疗,因此指南将以既往数据为基础,提出跨学科的国际化观点。指南涵盖了46项建议以及目前最新和最全面的报告。经过系统性文献检索,纳入466篇文章,是自2012年发表SAGES(214篇)以来,引文量的重大提升。尽管引文量有所增加,但支持指南建议的证据的总体质量仍然很低。为便于参考,将I-GOAL建议总结于表2。
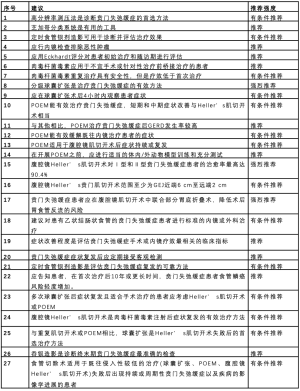
Full table
诊断
高分辨率测压被有条件地推荐为首选诊断方式,与芝加哥3.0分类系统一同用于临床实践。数据表明,高分辨率测压将贲门失弛缓症的诊断敏感性增加了近2倍,然而,只有较大的临床中心具备检测设备及相关临床经验。
次选诊断方式包括定时食管钡剂造影,而非传统钡剂吞咽造影。虽然部分作者证实其在区分贲门失弛缓症与其他疾病时具有较高的敏感性和特异性,但另一部分作者未能证明其对诊断和预后的帮助,存在一定争议[17-19]。然而,该检查能评估疗效并预测复发风险,建议作为贲门失弛缓症的诊疗手段。
内镜检查仍然是治疗的重要部分,能排除假性贲门失弛缓症和(或)恶性肿瘤等。建议首先排除其他潜在病症。恶性肿瘤继发假性贲门失弛缓症的高危征象包括GEJ结节和溃疡、GEJ顺应性降低及内镜进胃困难。
药物治疗
作者未找到药物治疗贲门失弛缓症的充足证据,不建议应用硝酸盐、钙通道阻滞剂或磷酸二酯酶抑制剂缓解患者的症状。
肉毒杆菌毒素注射
虽然肉毒杆菌毒素注射仍是贲门失弛缓症应用最广的治疗手段,但证据不支持其成为主要的治疗方式。注射肉毒杆菌毒素安全性较高。据报道,与腹腔镜肌切开术和球囊扩张术相比,三者在6个月时症状改善相似。然而,多项研究和一项Cochrane综述[20]表明,患者1年后复发率很高。对于年龄在50岁以下、适合手术或适合球囊扩张的患者,建议采用其他治疗方案。对于不适合更持久选择的患者,重复注射肉毒杆菌毒素是安全可行的选择,但后续治疗可能不如首次应用有效。没有证据证明食管内肉毒杆菌毒素注射对Ⅲ型贲门失弛缓症患者有效。
球囊扩张
球囊扩张应用广泛,是贲门失弛缓症治疗中的重要部分。由于相关报道中对“治疗成功”的定义及进行单次或多次扩张的要求不同,研究结果也因此不同。其中几项研究表明,球囊扩张与肌切开术在初次治疗中疗效相当,但球囊扩张的副作用更大,症状复发率更高,据报道48%的患者5年后症状复发。由于单次治疗效果不理想,现有证据建议采取分级扩张治疗,但未提及最佳治疗间隔及球囊扩张时长。在术后管理方面,此前的指南建议,应用质子泵抑制剂预防术后慢性继发性胃食管反流病。而I-GOAL建议除有症状患者外,不常规预防性抗酸治疗。
POEM
在短期及中期随访阶段,与腹腔镜下肌切开术和球囊扩张术相比,POEM更为有效,但其长期疗效尚不明确,对比研究证明,POEM与肌切开术疗效相近甚至稍好。有趣的是,尽管尚无研究对POEM与球囊扩张术进行比较,但既往研究将肌切开术和球囊扩张术视为等效,可作为参考。需要注意的是,随着POEM的广泛应用,发现不同医疗机构达到熟练的学习曲线在4~40例不等,因此I-GOAL建议在实际操作前充分监督学习过程,鼓励尽可能使用模拟设备练习(体内、体外、视频模拟)。同样,由于缺乏可靠的数据证实POEM远期预后及术后反流率,建议患者在充分咨询后做出合理选择。
外科治疗
自SAGES和AGA发表的指南以来,腹腔镜Heller’ s肌切开术的证据基础变化不大,I-GOAL指南得出相同的结论并不意外。腹腔镜下贲门肌切开术仍是治疗ChicagoⅠ型和Ⅱ型贲门失弛缓症的首选方法。为保证治疗效果,肌切开术范围从GEJ近端6 cm至远端至少2 cm。虽然仍没有研究比较不同的近端肌切开长度与疗效的关系,但近端切开范围常受到腹腔镜下经腹入路安全性的限制,远端含有平均长度小于4 cm的GEJ高压复合体(high pressure complex)。仅建议部分患者接受胃底折叠术,以预防术后反流疾病的发生。没有证据证明胃底折叠术会影响术后吞咽功能。
复发性贲门失弛缓症
对于初次治疗失败的患者,其治疗更为复杂。建议扩张术后复发的患者通过肌切开术或POEM缓解症状。注射肉毒杆菌毒素后复发的患者首选安全性较高的肌切开术。建议肌切开术后复发的患者接受球囊扩张术治疗,成功率为50%~90%。有证据表明,球囊扩张的疗效与再次行肌切开术或POEM相似,因此,初次治疗时选择侵入性较小的治疗措施更为合理。但初次POEM后复发的患者球囊扩张疗效不佳,应考虑再次行POEM或补救性Heller’ s肌切开术。由于复发领域仅有少量的轶事数据支持,尽管有三项试验正在继续招募,但I-GOAL的作者还不能对复发领域提供正式的建议。
总结
虽然现有指南在评估和总结数据的基础上,已能明确指导临床决策,但越来越多的人建议在多学科团队(multi-disciplinary team, MDT)会议上讨论复杂良性上消化道疾病的管理。由于贲门失弛缓症经内外科医生共同管理,这种多学科公开讨论极具价值。随着更先进的诊断技术的发展,采取个体化的治疗策略变得至关重要。未来几年,随着POEM远期预后数据完善、机器人肌切开术的发展,以及用于治疗而非缓解疾病的干细胞疗法的出现,贲门失弛缓症的指南将被改写。考虑到贲门失弛缓症仍属于少见病,培养并保障医生的专病诊治能力相对困难。根据地区医疗资源和护理互联能力,尽可能将患者集中于大容量专病中心。通过客观的手术前后评估,为患者提供专门的研究结果衡量标准,改善患者预后的同时指导未来的临床实践。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Sarah Thompson) for the series “Achalasia” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aoe.2020.04.01). The series “Achalasia” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Xu JX, Li QL, Zhou PH. Practice guideline of peroral endoscopic myotomy of achalasia: Zhongshan experience. Zhonghua Wei Chang Wai Ke Za Zhi 2019;22:613-8. [PubMed]
- Spechler SJ. American gastroenterological association medical position statement on treatment of patients with dysphagia caused by benign disorders of the distal esophagus. Gastroenterology 1999;117:229-33. [Crossref] [PubMed]
- Surgery of the Alimentary Tract. SSAT patient care guidelines. Esophageal achalasia. J Gastrointest Surg 2007;11:1210-2. [Crossref] [PubMed]
- Stefanidis D, Richardson W, Farrell TM, et al. SAGES guidelines for the surgical treatment of esophageal achalasia. Surg Endosc 2012;26:296-311. [Crossref] [PubMed]
- Vaezi MF, Pandolfino JE, Vela MF. ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol 2013;108:1238-49; quiz 1250. [Crossref] [PubMed]
- Malagelada JR, Bazzoli F, Boeckxstaens G, et al. World Gastroenterology Organisation global guidelines: dysphagia--global guidelines and cascades update September 2014. J Clin Gastroenterol 2015;49:370-8. [Crossref] [PubMed]
- Kahrilas PJ, Katzka D, Richter JE. Clinical practice update: the use of per-oral endoscopic myotomy in achalasia: expert review and best practice advice from the AGA Institute. Gastroenterology 2017;153:1205-11. [Crossref] [PubMed]
- Hirano I, Pandolfino JE, Boeckxstaens GE. Functional lumen imaging probe for the management of esophageal disorders: expert review from the clinical practice updates committee of the AGA Institute. Clin Gastroenterol Hepatol 2017;15:325-34. [Crossref] [PubMed]
- Sami SS, Haboubi HN, Ang Y, et al. UK guidelines on oesophageal dilatation in clinical practice. Gut 2018;67:1000-23. [Crossref] [PubMed]
- Inoue H, Shiwaku H, Iwakiri K, et al. Clinical practice guidelines for peroral endoscopic myotomy. Dig Endosc 2018;30:563-79. [Crossref] [PubMed]
- Zaninotto G, Bennett C, Boeckxstaens G, et al. The 2018 ISDE achalasia guidelines. Dis Esophagus 2018; [Crossref] [PubMed]
- Csendes A, Braghetto I, Henríquez A, et al. Late results of a prospective randomised study comparing forceful dilatation and oesophagomyotomy in patients with achalasia. Gut 1989;30:299-304. [Crossref] [PubMed]
- Richards WO, Torquati A, Holzman MD, et al. Heller myotomy versus Heller myotomy with Dor fundoplication for achalasia: a prospective randomized double-blind clinical trial. Ann Surg 2004;240:405-12; discussion 412-5. [Crossref] [PubMed]
- Campos GM, Vittinghoff E, Rabl C, et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg 2009;249:45-57. [Crossref] [PubMed]
- Boeckxstaens GE, Annese V, des Varannes SB, et al. Pneumatic dilation versus laparoscopic Heller's myotomy for idiopathic achalasia. N Engl J Med 2011;364:1807-16. [Crossref] [PubMed]
- Akintoye E, Kumar N, Obaitan I, et al. Peroral endoscopic myotomy: a meta-analysis. Endoscopy 2016;48:1059-68. [Crossref] [PubMed]
- Blonski W, Kumar A, Feldman J, et al. Timed barium swallow: diagnostic role and predictive value in untreated achalasia, esophagogastric junction outflow obstruction, and non-achalasia dysphagia. Am J Gastroenterol 2018;113:196-203. [Crossref] [PubMed]
- van Hoeij FB, Bredenoord AJ. Clinical application of esophageal high-resolution manometry in the diagnosis of esophageal motility disorders. J Neurogastroenterol Motil 2016;22:6-13. [Crossref] [PubMed]
- Krieger-Grübel C, Tutuian R, Borovicka J. Correlation of esophageal clearance and dysphagia symptom assessment after treatment for achalasia. United European Gastroenterol J 2016;4:55-61. [Crossref] [PubMed]
- Leyden JE, Moss AC, MacMathuna P. Endoscopic pneumatic dilation versus botulinum toxin injection in the management of primary achalasia. Cochrane Database Syst Rev 2014;CD005046 [PubMed]

张烁
教育背景
2018.09-2021.07 同济大学 内科学(专业学位硕士)
2013.09-2018.07 山西医科大学 临床医学(本科)
学术会议:
在中国内镜医师大会、中华消化内镜年会、全国肝病相关感染学术会议等中进行大会发言和壁报展示
获奖:
1. 2019-2020学年同济临床医学院优秀住院医师
2. 2020年同济医院第十八届“青稞节”学术类三等奖(更新时间:2021/8/4)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Peckham-Cooper A, Coe P, Cockbain AJ. Achalasia: an easy to swallow summary of the evolution in guidelines. Ann Esophagus 2020;3:17.


