微创经裂孔食管癌根治术
概况
食管切除术用于食管良性疾病及食管癌的治疗,Orringer等人[1]于1978年报道了经裂孔食管癌根治术并经颈部吻合,这一术式最终发展成为一种安全、可重复、基本满足肿瘤学治疗要求的术式[2,3]。与其他类型的食管癌根治术相比,该术式的优势在于避免了胸腔切口,从而减少了呼吸系统并发症的发生;在颈部进行食管吻合,即使发生吻合口瘘,也较少引起严重并发症。但胸部淋巴结清扫不完全是其主要弊端,这是由于该术式采用钝性方法切除纵隔淋巴结。但若将经裂孔食管癌根治术与其他术式进行比较时,肿瘤学预后没有明显差异。
Horgan等人于2003年报道了首例腹部机器人辅助及颈部开放术式的经裂孔食管癌根治术[4]。多中心的病例均显示该术式与其他术式相比,预后没有明显差异[5-7]。Bumm 等人于1993 年率先描述了腔镜辅助的颈部入路手术,这使得术者可进行更完整的胸部淋巴结清扫术。经过不断改进,这项技术现在采用的手术切口更小,术中充气量也更少[8,9]。经裂孔的微创食管癌根治术目前有两种术式:结合机器人和腔镜辅助的腹部和颈部入路手术[10,11],以及单机器人辅助经腹经颈的食管癌根治术[12,13]。大多数外科医生偏向进行小切口开腹来提取标本。
本文作者之一(DS Demos)分享了使用机器人辅助腹部和腔镜辅助颈部入路的微创食管癌根治术的手术技术。机器人辅助腹部手术的主要优点是腔镜的放大作用、立体的术野及机器人器械的灵活性,在腹部及颈部均使用腔镜辅助,可以进行完整的胸部淋巴结清扫。
术前准备
术前对患者进行充分的评估,包括胃镜,胸部、腹部及盆腔的增强CT检查,必要时可行PET-CT检查,如可行单纯内镜下切除时则需行超声胃镜评估。如果肿瘤靠近气管,必要时进行支气管镜检查。接受过放化疗的患者,术前应再次进行PET-CT评估分期,以确保肿瘤可切除。营养不良的患者可在新辅助治疗前行空肠造瘘术。
麻醉和定位
采用全身麻醉,经口单腔气管插管,仅需建立外周静脉通路。必要时可经右侧颈内静脉或任意一侧腹股沟建立中央静脉通路。术中无需常规监测动脉血压。麻醉完成后行胃镜检查再次确认肿瘤的位置。患者取仰卧位,双臂内收,颈部伸展并向右侧旋转,充分暴露左颈部。
常规操作
术中腹部和颈部操作同时进行,这样可明显缩短手术时间、减少麻醉药物用量。以上操作均有利于改善管状胃及吻合口的血流灌注,从而减少术后早期不良事件的发生。
机器人辅助的腹部手术
戳卡放置及与机械臂对接
腹部手术戳卡位置的选择和其他上消化道手术相同,在同一操作平面,均采用8 mm戳卡。我们习惯于在左肋缘下方应用气腹针建立气腹,镜孔选择在脐上方两横指偏左处,对于躯干较长的患者可进行适当调整。然后,于右肋缘下尽量靠侧方安全范围内,同一横向平面放置右侧机械臂,用于组织牵引。在前两个孔中间放置另外一个工作臂。接着,将腔镜放置在右侧两个孔中的任意一个,清楚地显示左侧腹腔。于左肋下尽量靠侧方安全范围内,与前3个孔在同一横向平面,建立一个戳卡。于镜孔和左肋缘下戳卡之间建立一个11 mm的辅助孔。最后,将Nathanson牵开器经剑突下置入腹腔。
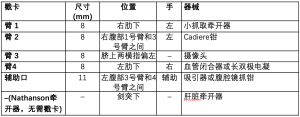
将患者置于轻度反Trendelenburg体位,然后将机器人置于合适位置,连接戳卡。在所有戳卡都连接就绪以后将机械臂分开,1号臂和2号臂置于患者的右侧,3号臂和4号臂置于患者的左侧,这些非常重要,因为这样可以为在颈部手术的外科医生留出足够的空间,进行纵隔部分的手术操作。手术器械在直视下置入腹腔(表1)。
Full table
手术技巧
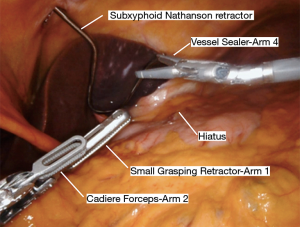
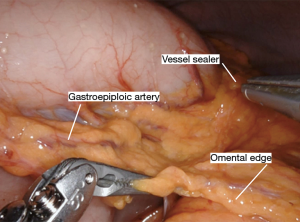
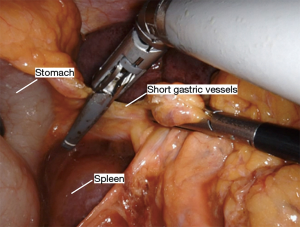
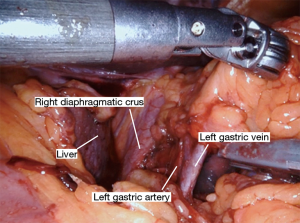
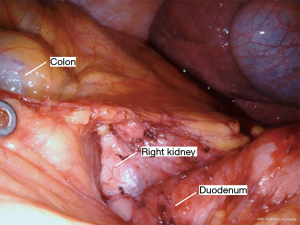
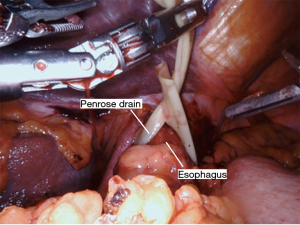
Nathanson 牵开器用于抬高肝脏显露食管裂孔,小型抓握牵开器用于抬高胃(图1)。然后使用血管闭合器切开大网膜,从胃网膜右动脉外侧进入小网膜囊(图2)。沿着这个方向游离,直到切断胃短动脉,到达裂孔(图3)。现在将胃进一步抬高,彻底游离胃后粘连。充分暴露胃左血管蒂(图4)。随后,我们通常右手持长的双极电凝钳,采用Kocher手法游离十二指肠(图5),充分游离后,幽门可在没有任何张力的情况下到达裂孔。然后我们打开肝胃韧带,经食管裂孔进入纵隔继续游离食管。将Penrose 引流管环绕胃食管交界部,助手牵拉Penrose引流管协助术野暴露(图6~图7),继续游离与颈部游离会师。可在这时离断胃左动脉,也可以在进入纵隔之前离断。离断胃左动脉可以使用血管闭合器,也可以由助手应用腹腔镜下切割缝合器完成。至此,胃已被完全游离,这可通过从颈部牵拉食道,同时观察胃的活动来进行验证。
腔镜辅助的颈部手术
颈部游离
采用颈部低位横切口,可取胸骨切迹上方一横指横切口,或胸锁乳突肌前缘斜切口。切开颈阔肌,放入Lonestar拉钩以暴露术野。特意选用Lonestar拉钩的原因是因为它小巧、易移动,以及通用性,可以在食管暴露期间根据需要进行调整。后续通常采用钝性游离,以避免损伤神经,尤其是左侧喉返神经。不常规离断肩胛舌骨肌,肩带肌肉通常位于颈椎后部。最后环周游离食管,并用Penrose引流管环绕。
纵隔游离
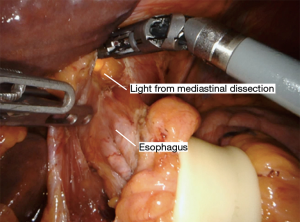
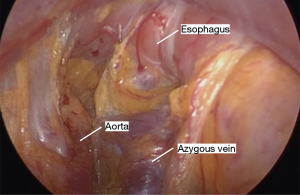
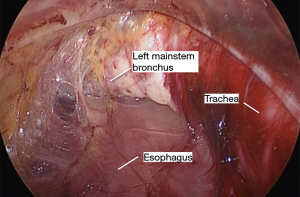
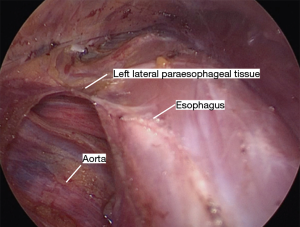
采用特定器械可以实现腔镜辅助下纵隔的游离(表2)。先从食管后方进行游离,这可防止先游离食管前方造成的血液和渗出液体在此部位的聚集而影响手术视野。将Penrose引流管向患者右肩方向牵拉,向前轻度抬高食管,显露食管后方的血管丛,前方显示屏的上半部分显示其纵行纤维条索。然后使用 LigaSure 将食道从后纵隔游离,在切断所有血管时要非常小心,因为即使是轻微的出血在这个角度处理也会很棘手。主动脉和奇静脉通常清晰可见(图8)。有时我们可以看到胸导管,但这不需要有意解剖。尽可能的向远端游离,最好是达到膈肌裂孔的水平。

Full table
接下来游离食管前方,将Penrose引流管向患者左肩方向牵拉,显露食管前方的血管丛,显示屏的底部可见其纵行纤维条索。同样,应用LigaSure将食管与包括气管和心包在内的前方器官分开(图9),尽可能地向远端游离。在这部分的游离过程中,腔镜摄像头会压迫气道,因此与麻醉团队的沟通很重要。
最后,通过将食管两侧剩余的结缔组织游离开,从而连接食管前方和后方的游离平面。通常最好从两个平面已经连接的食管近端开始,然后继续向远端推进(图10)。
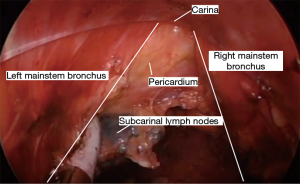
食管完全游离后,进行淋巴结清扫。任何肉眼可见的,未同食管一起游离的第8组淋巴结都需要清扫。有时可以看到并轻松清扫3组淋巴结。使用这种方法进行7组淋巴结清扫具有挑战性,但通常可以在充分止血的同时顺利完成。术中可以通过识别第7组淋巴结组织的顶点来定位隆突,淋巴结的清扫从隆突下开始,沿左右主支气管前方向心包表面推进。然后将第7组的淋巴结整块移除(图11)。
吻合
在颈部切断食管,应用一长约2.54 cm的Penrose引流管将近端食管牵出颈部切口,确保可以牵出6 cm的食管,用于后续的无张力吻合。断开机器人连接,取上腹部正中小切口,放置切口保护套。经上腹部小切口牵出标本,必要时排空胃内容物,然后自胃左动脉远端胃小弯处开始制作管状胃,连同小弯侧淋巴结一并切除,应用切割缝合器制做一个平行于胃大弯、直径约4 cm的管状胃,在应用每个缝合钉时适当将胃拉直,最后将标本与管状胃分开,将管状胃经后纵隔食管床径路拉至颈部。
我们更倾向于使用60 mm吻合器加外膜包埋的2层缝合吻合术,具体操作如下:首先,将食管末端和管状胃的头端小心地从颈部切口拉出并相互靠拢,于管状胃切开一小口,在食管残端开口和管状胃开口附近预留三针缝合。然后,将吻合器钉砧侧插入胃腔,钉仓侧插入食管,将食管和管状胃放至合适位置后闭合吻合器。自吻合器头开始至管状胃和食管开口,在吻合器两侧采用丝线间断缝合,在吻合口外侧完成一层手工缝合。接着,激发吻合器形成食管和管状胃的共同腔道,经此腔道留置鼻胃管。最后,使用30 mm Proximate TX 吻合器(强生,辛辛那提,俄亥俄州,美国)关闭残端完成吻合,残端缝合包埋。
湿腹纱覆盖腹部切口保护套,钳夹腹纱及切口保护套临时关闭腹腔,建立气腹,再次连接机器人。镜下探查,确保管状胃笔直的穿过食管裂孔,并且无扭转缠绕。然后使用不可吸收缝线将管状胃固定于双侧膈肌角,以免管状胃或肠管经食管裂孔疝至胸腔。
如果需要空肠造瘘,可通过上腹部小切口,根据屈氏韧带位置确定空肠造口的理想部位。我们不会常规地在所有食管癌根治术中行空肠造瘘,因为一般情况下,该术式的术后并发症发生率低且术后恢复顺利。
术后护理
鼓励患者术后早期下床,给予静脉营养支持治疗,每日常规进行胸部X线片检查。如果已放置空肠造瘘,可经空肠造瘘管给药。鼻胃管给予持续负压吸引24小时,如果引流较少,则在术后第1天夹管。如果管胃无扩张且患者没有恶心,则在术后第2天拔除鼻胃管。经有资质的语言病理学家评估患者声音无明显异常,于术后第2天鼻胃管拔除后可开始进流食,并在患者可以耐受的情况下逐步过渡至半流食。由于接受颈部吻合术的患者发生喉返神经损伤的风险较高,因此所有患者在开始进食之前都要接受言语治疗评估。食管造影不作为术后常规检查。如果放置了空肠造瘘管,在术后第2天开始肠内营养,并根据患者情况逐步推进。患者通常在术后第5天出院。
结论
我们描述了一种微创经裂孔食管癌根治手术技术,本技术采用机器人辅助腹部操作,腔镜辅助颈部操作。机器人辅助腹部手术的主要优点是腔镜的放大作用、立体的术野及机械人器械的灵活性,在腹部及颈部均使用腔镜辅助,可以进行完整的胸部淋巴结清扫。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Christopher R. Morse and Uma M. Sachdeva) for the series “Minimally Invasive Esophagectomy” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aoe.2019.12.02). The series “Minimally Invasive Esophagectomy” was commissioned by the editorial office without any funding or sponsorship. DSD reports personal fees (Robotic Thoracic Surgery Proctor) from Intuitive Surgical, Inc., outside the submitted work. WBT reports personal fees (Robotic Thoracic Surgery Instructor and Observation Site Administrator) from Intuitive Surgical, Inc., outside the submitted work. NSL reports other (travel and courses) from Intuitive Surgical, outside the submitted work. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Orringer MB, Sloan H. Esophagectomy without thoracotomy. J Thorac Cardiovasc Surg 1978;76:643-54. [Crossref] [PubMed]
- Orringer MB. Transhiatal Esophagectomy: How I Teach It. Ann Thorac Surg 2016;102:1432-7. [Crossref] [PubMed]
- Orringer MB, Marshall B, Chang AC, et al. Two thousand transhiatal esophagectomies: changing trends, lessons learned. Ann Surg 2007;246:363-72; discussion 372-4. [Crossref] [PubMed]
- Horgan S, Berger RA, Elli EF, et al. Robotic-assisted minimally invasive transhiatal esophagectomy. Am Surg 2003;69:624-6. [PubMed]
- Dunn DH, Johnson EM, Anderson CA, et al. Operative and survival outcomes in a series of 100 consecutive cases of robot-assisted transhiatal esophagectomies. Dis Esophagus 2017;30:1-7. [Crossref] [PubMed]
- Galvani CA, Gorodner MV, Moser F, et al. Robotically assisted laparoscopic transhiatal esophagectomy. Surg Endosc 2008;22:188-95. [Crossref] [PubMed]
- Coker AM, Barajas-Gamboa JS, Cheverie J, et al. Outcomes of robotic-assisted transhiatal esophagectomy for esophageal cancer after neoadjuvant chemoradiation. J Laparoendosc Adv Surg Tech A 2014;24:89-94. [Crossref] [PubMed]
- Tangoku A, Yoshino S, Abe T, et al. Mediastinoscope-assisted transhiatal esophagectomy for esophageal cancer. Surg Endosc 2004;18:383-9. [Crossref] [PubMed]
- Mori K, Aikou S, Yagi K, et al. Technical details of video-assisted transcervical mediastinal dissection for esophageal cancer and its perioperative outcome. Ann Gastroenterol Surg 2017;1:232-7. [Crossref] [PubMed]
- Fujiwara H, Shiozaki A, Konishi H, et al. Transmediastinal approach for esophageal cancer: A new trend toward radical surgery. Asian J Endosc Surg 2019;12:30-6. [Crossref] [PubMed]
- Seto Y, Mori K, Aikou S. Robotic surgery for esophageal cancer: Merits and demerits. Ann Gastroenterol Surg 2017;1:193-8. [Crossref] [PubMed]
- Egberts JH, Schlemminger M, Hauser C, et al. Robot-assisted cervical esophagectomy (RACE procedure) using a single port combined with a transhiatal approach in a rendezvous technique: a case series. Langenbecks Arch Surg 2019;404:353-8. [Crossref] [PubMed]
- Nakauchi M, Uyama I, Suda K, et al. Robot-assisted mediastinoscopic esophagectomy for esophageal cancer: the first clinical series. Esophagus 2019;16:85-92. [Crossref] [PubMed]

张勿扬
2015年7月:作为硕士研究生毕业于北京大学外国语学院英语翻译专业。
2015年7月至今:任职于中南大学湘雅医院临床技能训练中心,负责医学文献整理与翻译、医学人文课程研发,以及临床技能培训教辅工作。擅长医学英语翻译。(更新时间:2021/8/23)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Demos DS, Tisol WB, Lui NS. Minimally invasive transhiatal esophagectomy. Ann Esophagus 2019;2:21.