辅助小切口的微创食管切除术
简介
食管切除术的特殊性在于需要采用两野或三野手术操作来进行肿瘤切除和重建。目前,由于其复杂性,食管切除术主要在三级医学中心进行。随着麻醉学、器械和手术技术的进步,自20世纪90年代以来,减少手术创伤的可能性越来越大。过去二十年间,全球对食管手术领域中更小切口和微创方法的追求已成为现实[1-3]。此外,这一趋势逐渐得到文献综述中一级证据的支持,迄今为止,有3项前瞻性和随机临床试验证明了此类方法的益处,即使在新辅助治疗后的病例中也是如此[4-6]。然而,微创食管切除术(MIE)的主要问题在于胃重建和吻合口的制作。由于这些原因,许多外科医生对使用微创技术的吻合仍然不满意。因此,他们中的许多人选择了小切口辅助和微创手术的组合来克服这个问题并且保留了微创手术的优点[7,8]。
小切口辅助微创手术是通过在手术的两个阶段(腹部或胸部)之中的一个阶段应用微创技术,将微创手术与开放手术相结合,可以在腹部阶段使用腹腔镜,也可以使用在胸部阶段进行。出于对可能会遇到的问题的考虑,可以在手术前确定是否使用小切口辅助技术,将常规开放手术定于两个阶段其中之一。此外,提前决定小切口辅助手术还可以避免在微创手术期间的两个阶段进行术中转换,并且保留微创手术的优点。
小切口辅助手术技术研究最多的是腹腔镜辅助切口的Ivor Lewis食管切除术,其中胃游离过程在腹腔镜下进行,而胸腔内吻合术的程序以标准方法进行。该技术特别适用于胃食管交界处(GEJ)的腺癌或食管下段肿瘤。此外,还有辅助小切口的VATS食管切除术联合开腹术,但有关该术式的文献很少。
本综述的目的是阐述小切口辅助微创食管切除术的几种技术并讨论这些术式的疗效。
手术技术
在图1中小切口辅助MIE的几种方法总结,不同的吻合位置。
腹腔镜小切口辅助Ivor Lewis 食管切除术
小切口辅助的腹腔镜Ivor Lewis食管切除术包含腹腔镜下胃游离,经右开胸的整块食管切除胸内吻合。腹腔镜手术采用CO2气腹灌注,患者取反向特伦德伦伯卧位,采用仰卧分腿姿势(法式姿势)。该术式一般需要5个切口(通常2个5 mm孔、2个11 mm孔和1个12 mm孔)。胃游离过程与开放手术相同,包括胃肝韧带和大网膜的分离,直到到达胃短血管。大网膜完全分开,保留胃网膜右血管完好无损。使用超声刀(谐波手术刀®)可以轻松进行解剖。胃左血管在胰腺的上方被解剖和分开。使用夹子或血管自动闭合器进行切断。根据标准D2淋巴结切除术(腹腔干、脾脏、左肝总淋巴结和胃左淋巴结站)的定义进行根治性腹部淋巴结清扫。一个不完整的宽4 cm的管状胃由平行于胃小弯向胃网膜右动脉方向钉合来获得(SC45 A Echelon Flex Endopath Stapler®, 45 mm金色钉)。在腹部阶段开始制作管状胃,并在胸部阶段结束。可以使用吲哚菁绿(ICG)荧光成像检查血管的完整性并进行管状胃的活力评估。通常在手术结束时在腹腔镜下增加一个空肠造瘘口。不需要放置腹部引流。然后患者转向左侧卧位,进行右后外侧开胸手术,需要使用左双腔管(或在失败的情况下使用支气管内封堵术)对侧单肺通气。奇静脉弓切断后用传统方式行整体的食管切除。进行根治性和标准化的纵隔淋巴结清扫术,无论组织学亚型如何,均包括以下几个淋巴结站:隆突下、左右侧气管、食管旁和胸导管。胸内的端侧吻合可以通过不同的技术来执行:手工吻合,机械(25 mm自动环形吻合器)或半自动的吻合。在鼻胃管中注射亚甲蓝测试检查吻合口的完整性。吻合口周围放置两个胸管。
胸腔镜Ivor Lewis 食管切除术
胸腔镜辅助小切口的Ivor Lewis食管切除结合了开腹的胃游离,和经右侧胸腔下食管癌整块切除。在胸腔镜下进行胸腔内吻合术。目前,该技术已被放弃,因为难点在于吻合口的对合。这种技术现在被完全MIE Ivor Lewis手术(VATS或机器人手术)所取代。
辅助小切口的 McKeown 食管切除术
McKeown食管切除术包括三野手术和颈部胃重建。在这种手术中,将微创技术应用于腹部阶段(腹腔镜手术)或通过VATS进行胸部阶段手术,微创手术与开放入路手术相结合。辅助小切口的McKeown手术也可能是由于在全MIE手术两个阶段中需要中转为开放手术而进行的。
腹腔镜下McKeown 食管切除术
这种术式的适应证是预计胸部解剖时会遇到麻烦,需要考虑首选开胸手术。腹部阶段采用微创方法。开胸可能是在胸部接受高剂量辐射后、之前进行过胸部手术、肿瘤巨大或需要临近的肺或纵隔病灶切除的情况下的选择。该术式从右后外侧开胸术开始,以标准方式进行食管游离和淋巴结清扫术。完成胸部阶段手术后,患者翻身并置于仰卧分腿姿势(法式姿势),左臂沿着身体摆放行左侧颈部切口。腹腔镜腹部手术过程与上述完全相同。胃游离和淋巴结清扫是在使用CO2气腹的情况下进行的。在幽门前2 cm处开始制作管状胃,以获得一条4 cm宽的管状胃到达颈部。制作管状胃完全在镜下使用8或9个自动缝合钉(Echelon®45金钉)完成。然后将管状胃在食管胃交界处膈肌下用两针缝合到切除的标本上。在腹腔镜下,将切除的标本和管状胃通过后纵隔轻柔地从左侧颈部切口拉出。然后通过颈部切口取出要切除的标本,再通过手工吻合方式或通过半机械吻合方式进行端侧或侧侧吻合。另一种可选术式是通过用Alexis切口牵开器固定的5 cm腹部正中手术切口在体外制作管状胃。此术式需要先前在后纵隔中放置导管(鼻胃管或胸管)以将管状胃拉到颈部,然后通过腹部小切口取出切除的标本。将管状胃与导管缝合,并在腹腔镜下通过后纵隔轻柔地拉至颈部切口。
VATS McKeown 食管切除术
这种术式的适应证为,预期腹部解剖会遇到困难,需要考虑进行剖腹手术。通常在剖腹手术前进行VATS食管游离。这可能是由于腹部接受了高剂量辐射、之前有腹部手术史、瘤体巨大侵犯膈肌或胰腺、需要切除临近腹部脏器或在考虑为管状胃采用不同的重建途径时(胸骨前或胸骨后)。需要注意的是,如考虑用胃以外的其他替代物进行剖腹手术(结肠间置)时,也可以使用辅助小切口VATS食管切除术。该术式先行胸腔镜下食管游离[9,10]。患者可以采取俯卧位也可以采取左侧卧位。每个体位都有一些优点和缺点,俯卧位优点是不需要双腔管,患者采用单腔管插管俯卧位,右肺因CO2鼓入(8 mmHg)而塌陷,缺点是患者难以翻身,术中中转开胸时暴露不良,手术一般需要三个或四个孔(第4、第6和第8肋间)。食管游离是通过标准化的技术包括打开胸膜、切断奇静脉、整块的食管解剖和纵隔淋巴结清扫进行。在食管周围用Penrose引流管“悬吊”使食管解剖更容易。在胸腔底部结扎胸导管。在手术的第二阶段,不横断食管以保留消化道连续性便于将胃上拉到颈部。吻合口周围放置一个胸管,然后让患者仰卧,通过标准方式进行正中剖腹手术和左颈部切口。制作管状胃并将管状胃通过后纵隔拉到颈部。如果需要,在这种术式中也可以使用胸骨后途径。
辅助小切口食管切除术的结果
辅助小切口的食管切除术,包括腹腔镜手术
即使已经描述了几种辅助小切口食管切除术[2],但迄今为止最好的数据是来自辅助小切口 Ivor Lewis 手术 [5,7,11-15]。腹腔镜下胃游离的概念源于这样一种假设,即与传统剖腹手术相比,腹腔镜手术有可能显著减少呼吸系统的并发症。腹腔镜手术在其他适应证(如胆囊切除术)中的结果证明了这一假设[16-19]。剖腹手术后的膈肌功能障碍、免疫应激和呼吸功能受损已被认为是常规剖腹手术的结果。在这种情况下,腹腔镜手术无疑具有优于传统剖腹手术的几个优点。优点可概括如下:腹腔镜探查以排除癌变和不必要的剖腹手术、胃游离标准化、失血减少、容易结扎胃左和胃短血管,无论患者体重如何,都能很好地暴露,尤其是体重过重的患者,通过放大的视野进行根治性淋巴结清扫术,如果需要可以添加空肠造口术,最后腹腔镜手术可以加入加速康复外科(ERAS)计划。此外,腹腔镜手术的所有腹部操作部分似乎比VATS方法更容易教授。最后,这种方法似乎更有吸引力,因为与所有MIE吻合技术相比,采用开放式方法进行的胸腔内吻合术更容易[20]。对于在VATS下进行吻合遇到问题的外科医生来说,这是一个强有力的论据。
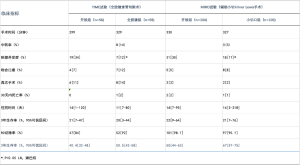
大多数现有文献是将辅助小切口腹腔镜Ivor Lewis手术与开放式常规手术进行比较的非对照研究。最近,法国随机化MIRO试验的结果提供了有关腹腔镜辅助小切口Ivor Lewis手术的短期、中期和长期结果的良好证据[5]。第一点也是最容易证明的一点是,腹腔镜手术对30天主要肺部并发症的良好效果(腹腔镜手术为15%,开腹手术为42%)[7]。进一步的研究也证实了这种并发症减少的数据[12-14]。第二点显示出腹腔镜手术对术后死亡率的实质性影响。基于倾向评分匹配研究,一项包括手术超过两年的三千名患者在内的全国性回顾性研究发现,腹腔镜手术可显著降低 30 天和 90 天死亡率(30 天死亡率:3.3% vs 5.9 %,P=0.029;90 天死亡率:6.9% vs 10.1%,P=0.018) [11]。腹腔镜手术的其他优点是减少失血、缩短手术时间和缩短住院时间。最后,与剖腹手术相比,手术疗效相同,转换率相似,淋巴结切除数量相似,R0切除率相似,远期结果相似[15]。
最近,MIRO 临床试验结果发表,提供了小切口辅助腹腔镜 Ivor Lewis 优于剖腹手术的一级证据 [5]。在这项前瞻性随机试验中,104名患者接受了剖腹手术,103名患者接受了腹腔镜手术。与开腹组 67 例患者 (64.4%) 相比,腹腔镜组 37 例患者 (35.9%) 的主要术后并发症显著降低 (OR 0.3;95% CI:0.1~0.5;P<0.001),达到了主要结果。获得的次要结果之一是腹腔镜组的肺部并发症减少:18名患者(17%)与开放组的31名患者(30%)相比(P=0.037)。MIRO 试验在 30 天死亡率相似(1.9%vs1.0%)的情况下,在切除的淋巴结数量和切除的完整性方面显示了相似的肿瘤学结果。此外,两种方法的长期生存率相似。与剖腹手术相比,腹腔镜手术甚至表现出出乎意料的更好的5年总体生存率和无病生存率。在一项辅助研究中,MIRO试验进一步证明,与剖腹手术相比,腹腔镜手术对健康相关的生活质量具有有益影响。这主要在于疼痛、社交和角色功能方面,并在手术后24个月内持续存在差异。这些益处可归因于腹腔镜组术后并发症的减少[21]。
MIRO 试验的主要结果见表1。短期结果与随机 TIME 试验的结果相对应,显示全MIE手术与开放手术的比较[4,5]。即使这两项试验在方法学和主要终点方面没有可比性,仍然存在的问题是全MIE手术的最大益处是在腹部还是胸部阶段?与传统的开放式术式相比,这两项试验的结果是,实验组的呼吸并发症以相同的幅度有益减少。然而,与 MIRO 试验(RR:0.5;0.26–0.96)相比,TIME 试验(RR:0.35;0.16–0.78)的减少似乎更好,但试验中包括的患者数量不同。毫不奇怪,与 TIME 试验相比,MIRO 试验显示出较低的转化率,因为在 MIRO 试验中,这两种方法是开放术式。然而,MIRO 试验中显示再手术的要求较少,表明技术难度较小,这可能与吻合技术有关。两项试验之间的肿瘤学预后似乎相当。然而,与实验组相比,TIME 试验的对照组显示出出乎意料的高不完全切除率,这表明纳入方案存在一些偏倚。最后,两种技术的长期结果都得到了报道,并表明两个实验组的存活率都更高。在 TIME 试验中,开放组的3年总生存率为40%,而MIE组为50%。MIRO试验中,开放组3年和5年总生存率分别为55%和39%,辅助小切口组为67%和60%。在 TIME 试验之外,另外两项回顾性研究将辅助小切口Ivor Lewis 食管切除术与完全 MIE 进行了比较 [22,23]。两项研究的结论都没有发现这两种技术中的任何一种有任何明显的优势。
到目前为止,这些基础研究可以得出的结论是,MIE技术(辅助小切口或全腔镜)在食管切除术的腹部阶段使用腹腔镜对术后呼吸功能有很大的好处,没有任何肿瘤长期预后方面的损失。无论胸腔手术使用何种技术,腹腔镜手术都应被视为一种新的标准术式。
包括VATS在内的辅助小切口食管切除术
与开腹手术结合的VATS在内的小切口食管切除术结果相关的数据很少[1,9,10,24,25]。VATS 技术是多变的,包括开剖腹手术的 VATS Ivor Lewis 手术和小切口辅助McKeown 食管切除术。此类手术的复杂性导致学习曲线十分陡峭,需要治疗至少40名患者才能见效,VATS 小切口辅助 Ivor Lewis 手术在胸腔镜下进行吻合术的手术没有得到很好的报道。需要更多有关吻合技术细节的详细信息,才能使这种术式标准化,并成为广为接受的方法在世界范围内广泛传播。迄今为止,至少有5~6种这样的技术相关报道和成果(全机械、半自动、圆形、手工吻合、经口OrVil EEA、机器人)[26]。
结论
辅助小切口食管切除术以小切口辅助腹腔镜Ivor Lewis 食管切除术为代表。这种技术看起来安全、可重复且易于教授,无需对胸腔内吻合技术进行任何修改,而全 MIE手术需要在胸腔镜下进行吻合,迄今为止结果令人失望。在不久的将来,胸腔镜下吻合技术的标准化和机器人手术的进展可能会克服这一点。
MIRO 试验提供了很好的证据,表明腹腔镜在食管切除术的腹部阶段的独特使用对术后呼吸功能有巨大的益处,与全MIE手术观察到的结果相同。这表明微创技术的最大好处更多地由腹腔镜手术而不是胸腔镜手术得来。此外,腹腔镜手术提供了出色的解剖效果,而不会影响肿瘤的长期疗效。无论采用何种 MIE 技术,腹腔镜手术都必须被视为一种新的标准方法,并应尽可能被纳入到所有食管癌切除术。ROMIO 研究的结果将阐明增加胸腔镜手术的好处,并将全 MIE手术视为新的手术标准 [27]。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Christopher R. Morse and Uma M. Sachdeva) for the series “Minimally Invasive Esophagectomy” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aoe.2019.12.01). The series “Minimally Invasive Esophagectomy” was commissioned by the editorial office without any funding or sponsorship. XBD serves as an unpaid editorial board member of Annals of Esophagus from Oct. 2019 to Sep. 2021. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Decker G, Coosemans W, De Leyn P, et al. Minimally invasive esophagectomy for cancer. Eur J Cardiothorac Surg 2009;35:13-20. [Crossref] [PubMed]
- Bonavina L, Asti E, Sironi A, et al. Hybrid and total minimally invasive esophagectomy: how I do it. J Thorac Dis 2017;9:S761-72. [Crossref] [PubMed]
- van der Sluis PC, Schizas D, Liakakos T, et al. Minimally Invasive esophagectomy. Dig Surg 2019; [Crossref] [PubMed]
- Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet 2012;379:1887-92. [Crossref] [PubMed]
- Mariette C, Markar SR, Dabakuyo-Yonli TS, et al. Hybrid Minimally Invasive Esophagectomy for Esophageal Cancer. N Engl J Med 2019;380:152-62. [Crossref] [PubMed]
- van der Sluis PC, van der Horst S, May AM, et al. Robot-assisted Minimally Invasive Thoracolaparoscopic Esophagectomy Versus Open Transthoracic Esophagectomy for Resectable Esophageal Cancer: A Randomized Controlled Trial. Ann Surg 2019;269:621-30. [Crossref] [PubMed]
- Briez N, Piessen G, Torres F, et al. Effects of hybrid minimally invasive oesophagectomy on major postoperative pulmonary complications. Br J Surg 2012;99:1547-53. [Crossref] [PubMed]
- Voron T, Lintis A, Piessen G. Hybrid esophagectomy. J Thorac Dis 2019;11:S723-7. [Crossref] [PubMed]
- Cuschieri A, Shimi S, Banting S. Endoscopic oesophagectomy through a right thoracoscopic approach. J R Coll Surg Edinb 1992;37:7-11. [PubMed]
- Gossot D, Fourquier P, Celerier M. Thoracoscopic esophagectomy: technique and initial results. Ann Thorac Surg 1993;56:667-70. [Crossref] [PubMed]
- Messager M, Pasquer A, Duhamel A, et al. Laparoscopic gastric mobilization reduces postoperative mortality after esophageal cancer surgery: A French Nationwide Study. Ann Surg 2015;262:817-22; discussion 822-3. [Crossref] [PubMed]
- Bjelovic M, Babic T, Spica B, et al. Could hybrid minimally invasive esophagectomy improve the treatment results of esophageal cancer? Eur J Surg Oncol 2016;42:1196-201. [Crossref] [PubMed]
- Yun JS, Na KJ, Song SY, et al. Comparison of perioperative outcomes following hybrid minimally invasive versus open Ivor Lewis esophagectomy for esophageal cancer. J Thorac Dis 2017;9:3097-104. [Crossref] [PubMed]
- Glatz T, Marjanovic G, Kulemann B, et al. Hybrid minimally invasive esophagectomy vs. open esophagectomy: a matched case analysis in 120 patients. Langenbecks Arch Surg 2017;402:323-31. [Crossref] [PubMed]
- Rinieri P, Ouattara M, Brioude G, et al. Long-term outcome of open versus hybrid minimally invasive Ivor Lewis oesophagectomy: a propensity score matched study†. Eur J Cardiothorac Surg 2017;51:223-9. [PubMed]
- Simonneau G, Vivien A, Sartene R, et al. Diaphragm dysfunction induced by upper abdominal surgery. Role of postoperative pain. Am Rev Respir Dis 1983;128:899-903. [PubMed]
- Ford GT, Whitelaw WA, Rosenal TW, et al. Diaphragm function after upper abdominal surgery in humans. Am Rev Respir Dis 1983;127:431-6. [Crossref] [PubMed]
- Coelho JC, de Araujo RP, Marchesini JB, et al. Pulmonary function after cholecystectomy performed through Kocher’s incision, a mini-incision, and laparoscopy. World J Surg 1993;17:544-6. [Crossref] [PubMed]
- Frazee RC, Roberts JW, Okeson GC, et al. Open versus laparoscopic cholecystectomy. A comparison of postoperative pulmonary function. Ann Surg 1991;213:651-3. [Crossref] [PubMed]
- Degisors S, Pasquer A, Renaud F, et al. Are Thoracotomy and/or Intrathoracic Anastomosis Still Predictors of Postoperative Mortality After Esophageal Cancer surgery?: A Nationwide Study. Ann Surg 2017;266:854-62. [Crossref] [PubMed]
- Mariette C, Markar S, Dabakuyo-Yonli TS, et al. Health-related Quality of Life Following Hybrid Minimally Invasive Versus Open Esophagectomy for Patients With Esophageal Cancer, Analysis of a Multicenter, Open-label, Randomized Phase III Controlled Trial: The MIRO Trial. Ann Surg 2019; [Crossref] [PubMed]
- Bonavina L, Scolari F, Aiolfi A, et al. Early outcome of thoracoscopic and hybrid esophagectomy: Propensitymatched comparative analysis. Surgery 2016;159:1073-81. [Crossref] [PubMed]
- Berlth F, Plum PS, Chon SH, et al. Total minimally invasive esophagectomy for esophageal adenocarcinoma reduces postoperative pain and pneumonia compared to hybrid esophagectomy. Surg Endosc 2018;32:4957-65. [Crossref] [PubMed]
- Law S, Fok M, Chu KM, et al. Thoracoscopic esophagectomy for esophageal cancer. Surgery 1997;122:8-14. [Crossref] [PubMed]
- Liu HP, Chang CH, Lin PJ, et al. Video-assisted endoscopic esophagectomy with stapled intrathoracic esophagogastric anastomosis. World J Surg 1995;745-7. [Crossref] [PubMed]
- Maas KW, Biere SS, Scheepers JJ, et al. Minimally invasive intrathoracic anastomosis after Ivor Lewis esophagectomy for cancer: a review of transoral or transthoracic use of staplers. Surg Endosc 2012;26:1795-802. [Crossref] [PubMed]
- Avery KN, Metcalfe C, Berrisford R, et al. The feasibility of a randomized controlled trial of esophagectomy for esophageal cancer--the ROMIO (Randomized Oesophagectomy: Minimally Invasive or Open) study: protocol for a randomized controlled trial. Trials 2014;15:200. [Crossref] [PubMed]

孙晓雁
1995年毕业于兰州大学医学院临床医学系,1998年获兰州大学医学院胸外科硕士学位,2001年获空军军医大学胸腔外科博士学位,导师是我国胸外科鼻祖之一的刘琨教授。自2001年博士毕业以后在空军军医大学唐都医院胸外科工作,2009年调动去解放军174医院胸外科工作(福建厦门),2018年转业后在厦门弘爱医院胸外科工作。本人一直从事胸外科临床工作,临床工作基本功扎实,临床思维逻辑清晰严密,了解国内外本学科的前沿进展及趋势。硕士博士期间毕业论文分别研究食管癌和肺癌的基因异常。爱好英语学习,本科期间通过大学英语6级考试,可不借助工具阅读外文文献。可以配合主刀完成高难度的胸外科手术,经治患者数千例,从未发生医疗差错及事故。在硕博研究生学习期间,掌握了临床及基础科研的方法和常用分子生物学技术,能够自主进行课题设计、实验规划、数据分析及相关的实验工作。工作期间主持承担省市级科研课题1项,获奖4次,发表论文10余篇。(更新时间:2021/8/13)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Fourdrain A, Thomas PA, D’Journo XB. Hybrid approaches to minimally invasive esophagectomy. Ann Esophagus 2019;2:20.